Строение белков — особенности, функции, биологическая роль
Содержание:
- Биосинтез белков
- Значение белков для организма человека
- Среди металлопротеинов много важных ферментов
- Структура белков
- Сравнение с другими системами классификации
- Нуклеопротеины
- Классы сложных белков
- Белковая композиция
- Структуры белков
- Уровни организации белковых молекул
- Особенности гликопротеинов и протеогликанов
- Функции хлорофилла
- Свойства белков
- Фосфопротеины
- Классификация белков
- Переваривание белков
- Краткая история открытия сложных белков
- Полноценные и неполноценные белки
- Функции белка
- Какие бывают хромопротеины
- Ферменты, их строение и функции
- Разнообразие простых белков
Биосинтез белков
Еще раз напомним, что в состав полипептидов живых организмов входит 20 аминокислот, среди которых есть незаменимые. Это лизин, метионин, фенилаланин и т. д. Они поступают в кровь из отделов тонкой кишки после расщепления в ней белковых продуктов. Чтобы синтезировать заменимые аминокислоты (аланин, пролин, серин), грибы и животные используют азотсодержащие соединения. Растения, являясь автотрофами, самостоятельно образуют все необходимые составные мономеры, представляющие сложные белки. Для этого в реакциях ассимиляции у них используются нитраты, аммиак или свободный азот. У микроорганизмов некоторые виды обеспечивают себя полным аминокислотным набором, а у других синтезируются только некоторые мономеры. Этапы биосинтеза белков протекают в клетках всех живых организмов. В ядре происходит транскрипция, а в цитоплазме клетки — трансляция.
Первый этап – синтез предшественника иРНК происходит при участии фермента РНК-полимеразы. Он разрывает водородные связи между цепями ДНК, и на одной из них по принципу комплиментарности собирает молекулу пре-иРНК. Она подвергается слайсингу, то есть созревает, и далее выходит из ядра в цитоплазму, образуя матричную рибонуклеиновую кислоту.
Для осуществления второго этапа необходимо наличие специальных органелл – рибосом, а также молекул информационных и транспортных рибонуклеиновых кислот. Еще одним важным условием является наличие молекул АТФ, так как реакции пластического обмена, к которым принадлежит биосинтез белков, происходят с поглощением энергии.
Значение белков для организма человека
Из белков состоят структурные элементы клеток организма, которые способствуют обновлению любых тканей и росту. В больших объемах протеин содержится в мышцах (около 45-50%), в хрящах и костях — около 15-20%, а остальные 15-20% приходятся на кожу. Чтобы организм нормально функционировал, человеку необходимо съедать не менее 1 г чистого протеина на один кг живого веса в сутки.
Если организм будет испытывать нехватку этих веществ, человек начнет страдать от белкового голодания. С помощью различных групп сложных белков в организме происходят метаболические процессы, а дефицит таких макроэлементов равен полному голоданию. Первыми симптомами того, что человеку недостает протеинов, является:
- резкая потеря веса;
- слабость в теле, ухудшение общего состояния;
- отказ от приема пищи;
- у детей приостанавливается рост и замедляется умственное развитие;
- У взрослых людей нарушается гормональный фон.
Если показатели нехватки протеинов достигли критической отметки, это может привести к летальному исходу. Стоит заметить, что протеины животного происхождения усваиваются желудком лучше всего. К таким продуктам можно отнести рыбу и морепродукты, молоко, кефир, куриное мясо и перепелиные яйца.
С опасностью белкового голодания могут столкнуться вегетарианцы, поэтому им нужно очень внимательно следить за количеством потребляемых протеинов. Опытные диетологи утверждают, что восполнить недостаток животной пищи в ежедневном рационе можно с помощью бобовых и злаковых культур, свежих овощей и грибов.
Люди, ведущие здоровый образ жизни, используют сложные макроэлементы в целях наращивания мышечной массы, а также для повышения выносливости организма и быстрого восстановления после физических нагрузок. Приверженцами принципа протеиновых диет, в большинстве случаев, являются бодибилдеры, но белок рекомендуется употреблять в больших количествах даже при минимальных физических нагрузках.
Значение белков для организма человека
Основная особенность спортивного питания — специальные протеиновые добавки. Лучше всего организмом усваивается яичный белок, а с помощью коллагенового протеина восстанавливается мышечная ткань, сухожилия и связки. Стоит заметить, что за короткий промежуток времени способен расщепляться сывороточный протеин. Чтобы белковые добавки хорошо усвоились в желудке, их рекомендуется принимать на ночь. Категорически запрещено и неверно употреблять протеины перед физическими нагрузками.
Перед тем, как пересматривать рацион и определять норму суточного потребления макроэлементов, рекомендуется проконсультироваться с квалифицированным диетологом, который способен объяснить все нюансы. Стоит помнить, что организм нуждается в достаточном количестве протеинов, желательно, чтобы это было 50% белков животного происхождения и 50% растительного.
Среди металлопротеинов много важных ферментов
Металлопротеин может включать в себя ионы нескольких металлов. Их наличие влияет на ориентацию субстрата в активном (каталитическом) центре фермента. Ионы металлов локализуются в активном центре и играют важную роль в проведении каталитической реакции. Часто ион выполняет функцию акцептора электронов.
Примеры металлов, содержащихся в структуре ферментных металлопротеинов:
- Медь включена в состав цитохромоксидазы, которая наряду с гемом содержит ион данного металла. Фермент участвует в процессе образования АТФ при работе дыхательной цепи.
- Железо содержат такие ферменты, как ферритин, выполняющий функцию депонирования железа в клетке; трансферрин – переносчик железа в крови; каталаза ответственна за реакцию обезвреживания перекиси водорода.
- Цинк – металл, характерный для алкогольдегидрогеназы, участвующей в окислении этилового и подобных ему спиртов; лактатдегидрогеназа – фермент в метаболизме молочной кислоты; карбоангидраза, катализирующая образование угольной кислоты из CO2 и H2O; щелочная фосфатаза, выполняющая гидролитическое расщепление эфиров фосфорной кислоты с различными соединениями; α2-макроглобулин – антипротеазный кровяной белок.
- Селен входит в состав тиреопероксидазы, участвующей в процессе образования гормонов щитовидной железы; глутатионпероксидазы, выполняющей антиоксидантную функцию.
- Кальций характерен для структуры α-амилазы – фермента гидролитического расщепления крахмала.
Структура белков
Что касается структуры молекулы белка, посмотрите, как ее можно классифицировать:
Первичная структура
Первичная структура определяется генетически. Это самая простая структура, где аминокислоты расположены линейно.
Вторичная структура
Для того чтобы структура белка была вторичной, первичная структура должна иметь ковалентно связанные аминокислоты. Таким образом, молекулы могут подвергаться вращению и, наконец, самостоятельно взаимодействовать тремя способами:
- Альфа-спираль : спиральная форма имеет место, когда возникают водородные связи между аминокислотами.
- Бета-листы : когда возникают водородные связи между аминокислотами и последующим образованием листа и жесткой структуры.
- Связи : являются нерегулярными структурами в ядре, и их образование происходит вне сворачивания белка.
Четвертичная структура
Эта структура имеет место посредством взаимодействия между одинаковыми или нет полипептидными цепями, которые группируются и образуют уникальную трехмерную структуру.
Сравнение с другими системами классификации
Классификация SCOP больше зависит от ручных решений, чем полуавтоматическая классификация CATH , его главного конкурента. Человеческий опыт используется для определения того , некоторые белки являются эволюционно связаны между собой и , следовательно , должны быть отнесены к одной и той же надсемейства , или их сходство является результатом структурных ограничений , и , следовательно , они принадлежат к одной и той же складки . Другая база данных, FSSP , создается полностью автоматически (включая регулярные автоматические обновления), но не предлагает классификации, что позволяет пользователю сделать собственный вывод о значимости структурных отношений на основе попарных сравнений отдельных белковых структур.
Преемники SCOP
К 2009 году исходная база данных SCOP вручную классифицировала 38 000 записей PDB в строго иерархическую структуру. С ускоряющимся темпом публикаций по структуре белков ограниченная автоматизация классификации не успевала за ними, что привело к неполному набору данных. База данных расширенной структурной классификации белков (SCOPe) была выпущена в 2012 году с гораздо большей автоматизацией той же иерархической системы и полностью обратно совместима с SCOP версии 1.75. В 2014 году в SCOPe было повторно введено кураторство вручную, чтобы обеспечить точное распределение структуры. По состоянию на февраль 2015 года SCOPe 2.05 классифицировал 71 000 из 110 000 записей PDB.
Прототип SCOP2 был бета-версией Структурной классификации белков и системы классификации, которая была направлена на усиление эволюционной сложности, присущей эволюции структуры белков. Следовательно, это не простая иерархия, а направленная сеть ациклических графов, соединяющая суперсемейства белков, представляющих структурные и эволюционные отношения, такие как круговые перестановки , слияние доменов и распад доменов. Следовательно, домены не разделены строгими фиксированными границами, а скорее определяются их отношениями к наиболее похожим другим структурам. Прототип был использован для разработки базы данных SCOP версии 2. Версия 2 SCOP, выпущенная в январе 2020 г., содержит 5134 семейства и 2485 суперсемейств по сравнению с 3902 семействами и 1962 суперсемействами в SCOP 1.75. Уровни классификации организуют более 41 000 неизбыточных доменов, которые представляют более 504 000 белковых структур.
База данных эволюционной классификации белковых доменов (ECOD), выпущенная в 2014 году, аналогична расширению SCOPe версии 1.75 SCOP. В отличие от совместимого SCOPe, он переименовывает иерархию класса-свертка-суперсемейство-семейство в группу архитектура-X-гомология-топология-семейство (A-XHTF), причем последний уровень в основном определяется Pfam и дополняется кластеризацией HHsearch для некатегоризованных последовательностей. . ECOD имеет лучшее покрытие PDB среди всех трех преемников: он охватывает каждую структуру PDB и обновляется каждые две недели. Прямое сопоставление с Pfam оказалось полезным для кураторов Pfam, которые используют категорию уровня гомологии для дополнения своей «клановой» группировки.
Нуклеопротеины
Нуклеопротеины – белки, соединенные с нуклеиновыми кислотами. Они – неотъемлемая часть хранения и регуляции генетического материала, работы рибосом, выполняющих функцию синтеза белка. Самые простейшие формы жизни вирусов можно назвать рибо- и дезоксирибонуклеопротеинами, так как они состоят из генетического материала и белков.
Как происходит взаимодействие дезоксирибонуклеиновой кислоты (ДНК) и гистонов? В хроматине выделяют 2 вида белков, связанных с ДНК (гистоновые и негистоновые). Первые участвуют на начальной стадии компактизации ДНК. Молекула нуклеиновой кислоты обвивается вокруг протеинов с формированием нуклеосом. Образовавшаяся нить похожа на бусины, из них формируются суперспирализованная структура (хроматиновая фибрилла) и суперспираль (хромонема интерфазы). За счет действия гистоновых белков и протеинов более высоких уровней обеспечивается сокращением размерности ДНК в тысячи раз
Достаточно сравнить размер хромосом и длину нуклеиновой кислоты, чтобы оценить важность белков (6-9 см и 10-6 мкм, соответственно)
Классы сложных белков
Они были разработаны биохимиками, исходя из 3 критериев: физико-химических свойств, функциональных особенностей и специфики структурных признаков протеидов. К первой группе относятся полипептиды, различающиеся электрохимическими свойствами. Они делятся на основные, нейтральные и кислые. По отношению к воде белки могут быть гидрофильными, амфифильными и гидрофобными. Ко второй группе относятся ферменты, которые были рассмотрены нами ранее. Третья группа включает полипептиды, различающиеся химическим составом простетических групп (это хромопротеиды, нуклеопротеиды, металлопротеиды).
Рассмотрим свойства сложных белков более подробно. Так, например, кислый белок, входящий в состав рибосом, содержит 120 аминокислот и является универсальным. Он находится в белоксинтезирующих органеллах, как прокариотических, так и эукариотических клеток. Еще один представитель этой группы — белок S-100, состоит из двух цепей, связанных ионом кальция. Он входит в состав нейронов и нейроглии — опорной ткани нервной системы. Общее свойство всех кислых белков — это высокое содержание двухосновных карбоновых кислот: глутаминовой и аспарагиновой. К щелочным белкам относятся гистоны — протеины, входящие в состав нуклеиновых кислот ДНК и РНК. Особенностью их химического состава является большое количество лизина и аргинина. Гистоны вместе с хроматином ядра образуют хромосомы — важнейшие структуры наследственности клеток. Эти белки участвуют в процессах транскрипции и трансляции. Амфифильные протеины широко представлены в клеточных мембранах, образуя липопротеиновый бислой. Таким образом, изучив выше рассмотренные группы сложных белков, мы убедились в том, что их физико-химические свойства обусловлены строением белкового компонента и простетических групп.
Некоторые сложные белки клеточных мембран способны узнавать различные химические соединения, например антигены, и реагировать на них. Это сигнальная функция протеидов, она очень важна для процессов избирательного поглощения веществ, поступающих из внешней среды, и для её защиты.
Белковая композиция
Состав и другие характеристики белков являются предметом биохимии, которая является субдисциплиной биологии.
В состав белков входят углерод, водород, азот и кислород, и почти во всех из них присутствует также сера . Могут также присутствовать такие элементы, как железо, цинк и медь .
Белки в основном состоят из набора аминокислот, которые ковалентно связаны друг с другом.
Длинная цепочка аминокислот представляет собой полипептид .
Такие связи между аминокислотами называются пептидными связями .
Пептидные связи возникают как реакция между аминогруппой (органическое соединение, полученное из аммиака) из одной аминокислоты и карбоксильной группой (компонент карбоновых кислот) из другой.
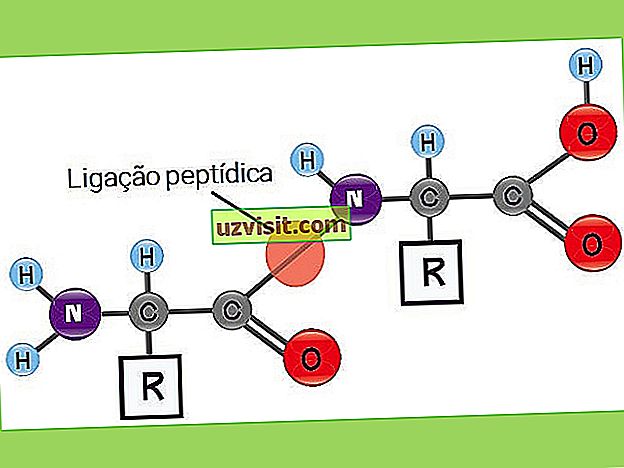
С = углерод; H = водород; O = кислород; N = азот; R = R группа или боковая цепь (аминокислотная идентичность).
Есть 20 аминокислот, которые могут по-разному сочетаться с образованием разных типов белков.
Узнайте больше о аминокислотах.
Структуры белков
Каждый белок в природе состоит из определенного количества структур, которые обусловливают сложность его строения. Они формируются в каналах эндоплазматической сети. С этими структурами сильно связаны и основные свойства белков — денатурация и ренатурация, которые мы рассмотрим позже.
Первичная структура
Данная структура определяет количество аминокислот в цепи пептидов. В молекуле возникают пептидные связи (рис.1).То есть эта структура представляет собой последовательность различных аминокислот, соединенных друг с другом пептидными связями.
Вторичная структура
Представляет собой альфа-спираль, которая прошита многочисленными водородными связями (рис.2).Еще данная структура может представлять собой бета-слой.Бета-слой (рис.3) — складчатая структура, состоящая из ряда параллельных полипептидных цепей, соединенных водородными связями. Является более прочным, чем альфа-спираль.
Рис. 3. Бета-слой
Третичная структура
Здесь полипептидная цепь компактно уложена в глобулу (рис.4).В глобулу могут входить ионные, водородные, дисульфидные связи. Между радикалами могут возникать гидрофобные и гидрофильные взаимодействия. Сюда же входят различные ферменты и антитела с глобулярным строением.
Рис. 4. Глобула
Четвертичная структура
Пожалуй, является наиболее сложной из всех. В ней несколько полипептидных цепей удерживаются в молекуле гидрофобными взаимодействиями и ионными связями (рис.5).Четыре глобулы соединены воедино. Данное строение имеет гемоглобин, чрезвычайно важный для человеческого организма.Теперь, после изучения основного строения белков, перейдем к краткому рассмотрению свойств этих биополимеров, которые вытекают из наличия всех указанных выше структур.
Уровни организации белковых молекул
Они представлены четырьмя различными конфигурациями. Первая структура — линейная, она наиболее проста и имеет вид полипептидной цепи, во время её спирализации происходит образование дополнительных водородных связей. Они стабилизируют спираль, которая называется вторичной структурой. Третичный уровень организации имеют простые и сложные белки, большинство растительных и животных клеток. Последняя конфигурация — четвертичная, возникает при взаимодействии нескольких молекул нативной структуры, объединенных коферментами, именно такое строение имеют сложные белки, выполняющие в организме разнообразные функции.
Особенности гликопротеинов и протеогликанов
Эти белки являются сложными веществами. Протеогликаны содержат большую долю углеводов (80-85%), у обычных гликопротеидов содержание составляет 15-20%. Уроновые кислоты присутствуют только в молекуле протеогликанов, их углеводы отличаются регулярным строением с повторяющимися звеньями. Какова структура и функции сложных белков гликопротеинов? Их углеводные цепи включают только 15 звеньев и имеют нерегулярное строение. В структуре гликопротеинов связь углевода с белковым компонентом обычно осуществляется через остатки таких аминокислот, как серин или аспаргин.
Функции гликопротеинов:
- Входят в состав клеточной стенки бактерий, костной соединительной и хрящевой ткани, окружают волокна коллагена, эластина.
- Играют защитную роль. Например, данную структуру имеют антитела, интерфероны, факторы свертываемости крови (протромбин, фибриноген).
- Являются рецепторами, которые взаимодействуют с эффектором – небольшой небелковой молекулой. Последняя, присоединяясь к белку, приводит к изменению его конформации, что приводит к определенному внутриклеточному ответу.
- Выполняют гормональную функцию. К гликопротеинам относится гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Транспортируют вещества в крови и ионы через клеточную мембрану (трансферрин, транскортин, альбумин, Na+ ,К+ -АТФаза).
К гликопротеиновым ферментам относятся холинэстераза и нуклеаза.
Функции хлорофилла
Как мы уже упоминали ранее, сложные белки могут образовывать комплексы с пигментами – окрашенными органическими веществами. Их цвет зависит от хромоформных групп, которые избирательно поглощают определённые спектры солнечного света. В клетках растений есть зеленые пластиды – хлоропласты, содержащие пигмент хлорофилл. В его состав входят атомы магния и многоатомный спирт фитол. Они связаны с белковыми молекулами, а сами хлоропласты содержат тилакоиды (пластинки), или мембраны, связанные в стопки – граны. В них находятся фотосинтезирующие пигменты – хлорофиллы — и дополнительные каротиноиды. Здесь же находятся все ферменты, используемые в фотосинтетических реакциях. Таким образом, хромопротеиды, к которым относится и хлорофилл, выполняют важнейшие функции в обмене веществ, а именно в реакциях ассимиляции и диссимиляции.
Свойства белков
Примем во внимание два главных свойства:
- Денатурация — нарушение природной структуры белка при воздействии на него определенных факторов (высокой температуры, излучения, воздействия кислот, щелочей, солей). Обратимая денатурация называется ренатурацией — процесс обратим, если не разрушается первичная структура, являющаяся основной. При необратимой денатурации затрагивается первичная структура, которая восстановиться уже не может. В качестве примера такого процесса можно привести яйцо, которое на сковороде превращается в яичницу. В этом случае строение белка полностью нарушено и не восстановимо.
- Белки — органические растворители. Данные макромолекулы используются и как отличные растворители.
Обязательно стоит перейти к вопросу о классификациях белков. Разные биополимеры имеют разное строение, а также физические свойства.
Рис. 5. Четвертичная структура белка
Фосфопротеины
Что входит в состав сложных белков фосфопротеинов? Для данной категории характерно присутствие фосфатной группы, которая связана с белковой частью через аминокислоты с гидроксилом (тирозин, серин или треонин). Какие функции выполняет фосфорная кислота, находясь в структуре белка? Она изменяет структуру молекулы, придает ей заряд, повышает растворимость, влияет на свойства белка. Примерами фосфопротеинов являются казеин молока и яичный альбумин, но в основном к данной категории сложных белков относятся ферменты.
Фосфатная группа играет важную функциональную роль, так как многие белки связаны с ней не постоянно. В клетке все время происходят процессы фосфорилирования и дефосфорилирования. В результате выполняется регуляция в работе белков. Например, если гистоны – белки, соединенные с нуклеиновыми кислотами переходят в фосфорилированное состояние, то активность генома (генетического материала) возрастает. От фосфорилирования зависит активность таких ферментов, как гликогенсинтаза и гликогенфосфорилаза.
Классификация белков
Классификация белков варьируется в зависимости от основного фактора, принятого во внимание
Классификация композиции
Когда объектом исследования является состав белков, их можно разделить на две группы:
- Простые белки : это те, которые при гидролизе выделяют только аминокислоты.
- Конъюгированные белки представляют собой белки, которые во время гидролиза выделяют аминокислоты и непептидный радикал.
Классификация по количеству полипептидных цепей
Что касается количества полипептидных цепей, белки могут быть классифицированы как:
- Мономерные белки : это белки, которые имеют только полипептидную цепь.
- Олигомерные белки : белки, образованные более чем одной полипептидной цепью.
Классификация по форме
Что касается формы, белки можно классифицировать на два типа:
- Волокнистые белки: в волокнистых белках полипептидные цепи свертываются как веревка. Одной из характеристик волокнистых белков является то, что они не растворимы в водных растворах. Кроме того, они несут ответственность за прочность и гибкость конструкций, в которых они присутствуют. Примеры волокнистых белков : кератин, коллаген
- Глобулярные белки: полипептидные цепи глобулярных белков изгибаются приблизительно в сферическую или глобулярную форму, делая их похожими на глобус. Глобулярные белки обычно растворимы в водных растворах. Примеры глобулярных белков : гемоглобин, ферменты.
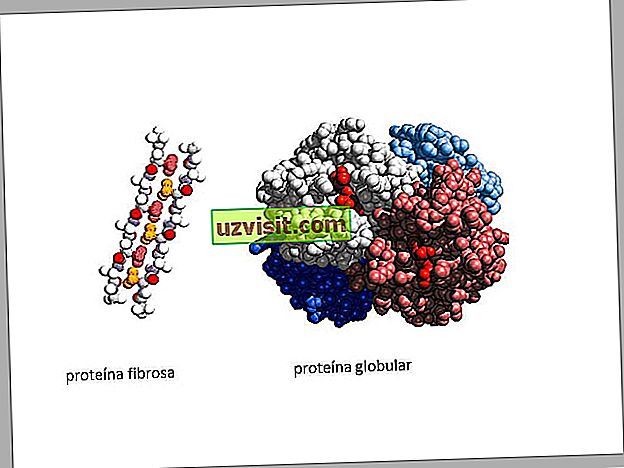
Изображения волокнистого белка и глобулярного белка
Узнайте больше о гемоглобине и ферменте.
Переваривание белков
Процесс переваривания белка начинается в желудке. Соляная кислота, присутствующая в ней, инициирует процесс, денатурируя белки, то есть разрушая водородные связи их структуры.
После этого протеолитические цепи теряют свою форму и подвергаются действию ферментов. В этот момент фермент пепсин заставляет белки превращаться в более мелкие молекулы, то есть пепсин вызывает частичную деградацию белка и гидролизует пептидные связи.
Вторая стадия переваривания белка происходит в тонкой кишке. В нем белки подвергаются действию панкреатических ферментов. После этого пептиды и аминокислоты поглощаются и попадают в печень.
Ферменты, участвующие в переваривании белка
Процент белков, выделяемых организмом в виде фекалий, соответствует примерно 1% от потребляемого количества.
Краткая история открытия сложных белков
Целенаправленно изучать функции и строение сложных белков ученые начали во второй половине 18 века, а французский химик Антуан Франсуа де Фуркруа в результате научных экспериментов получил такие макроэлементы, как глютен, альбумин и фибрин. Сложные белки были выделены учеными в отдельную молекулярную группу.
Сложныке белки
Что касается первой модели химического строения белков, то она была изобретена в 1838 году, а предложил ее Мулдер, основываясь на теории радикалов. До 1850 года данная модель считалась общепризнанной, а в 1852 г. белки стали называться протеинами. Во второй половине 19-го века специалисты приступили к изучению аминокислот, из которых состоят протеины. В 1895 г. немецким ученым Альбрехтом Косселем была выдвинута теория, в которой он утверждал, что аминокислоты — это основные структурные элементы сложных белков.
Обратите внимание! Классы сложных белков в биохимии являются высокомолекулярными органическими веществами. В состав молекулы протеина входят сотни аминокислот, которые представлены цепочкой пептидной связи
Полноценные и неполноценные белки
Белки, поступающие в организм с пищей, разделяются на биологически полноценные и биологически неполноценные.
Биологически полноценными называются те белки, в которых в достаточном количестве содержатся все аминокислоты, необходимые для синтеза белка животного организма. В состав полноценных белков, необходимых для роста организма, входят следующие незаменимые аминокислоты: лизин, триптофан, треонин, лейцин, изолейцин, гистидин, аргинин, валин, метионин, фенилаланин. Из этих аминокислот могут образоваться другие аминокислоты, гормоны и т. д. Из фенилаланина образуется тирозин, из тирозина путем превращений — гормоны тироксин и адреналин, из гистидина — гистамин. Метионин участвует в образовании гормонов щитовидной железы и необходим для образования холина, цистеина и глютатиона. Он необходим для окислительно-восстановительных процессов, азотистого обмена, усвоения жиров, нормальной деятельности головного мозга. Лизин участвует в кроветворении, способствует росту организма. Триптофан также необходим для роста, участвует в образовании серотонина, витамина РР, в тканевом синтезе. Лизин, цистин и валин возбуждают сердечную деятельность. Малое содержание цистина в пище задерживает рост волос, увеличивает содержание сахара в крови.
Биологические неполноценными называются те белки, в которых отсутствуют хотя бы даже одна аминокислота, которая не может быть синтезирована животными организмами.
Биологическая ценность белка измеряется количеством белка организма, которое образуется из 100 г белка пищи.
Белки животного происхождения, содержаться в мясе, яйцах и молоке, наиболее полоненные (70-95%). Белки растительного происхождения имеют меньшую биологическую ценность, например белки ржаного хлеба, кукурузы (60%), картофеля, дрожжей (67%).
Белок животного происхождения – желатина, в котором нет триптофана и тирозина, является неполноценным. В пшенице и ячмене мало лизина, в кукурузе мало лизина и триптофана.
Некоторые аминокислоты заменяют друг друга, например фенилаланин заменяет тирозин.
Два неполноценных белка, в которых недостает разлчных аминокислот, вместе могут составить полноценное белковое питание.
Функции белка
Помните, мы уже с вами говорили про основные функции белков? Обязательно почитайте.
Белки постоянно расходуются на нужды организма.
Они выполняют строительную, транспортную и защитную функцию, являются материалом для синтеза гормонов, ферментов, гемоглобина, а также синтезируют коллаген для суставов.
При их недостатке страдает мышечная масса, замедляются обменные процессы, снижается иммунитет и работоспособность.
Поэтому нам с вами необходимо ежедневно пополнять запасы белков, получая их с пищей.
Давайте вспомним некоторые моменты.
Белки выполняют в организме следующие важные функции:
Какие бывают хромопротеины
Хромопротеины содержат весьма разнообразные группы, которые объединяет только одно – наличие окраски в простетическом компоненте. Сложные белки данной категории подразделяются на: гемопротеины (содержат в структуре гем), ретинальпротеины (витамин А), флавопротеины (витамин В2), кобамидпротеины (витамин В12).
Гемопротеины классифицируются в зависимости от функций на не ферментативные (гемоглобиновый и миоглобиновый белок) и ферменты (цитохромы, каталазы, пероксидазы).
Флавопротеины содержат в качестве простетического компонента производные витамина В2 флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД). Данные ферменты также участвуют в окислительно-восстановительных превращениях. К ним относятся оксидоредуктазы.
Ферменты, их строение и функции
Это большая группа белков (около 2000), выполняющих роль веществ, влияющих на скорость протекания биохимических реакций в клетках. Они могут быть простыми (трепсин, пепсин) или сложными. Сложные белки состоят из кофермента и апофермента. Специфичность самого белка относительно соединений, на которые он воздействует, определяет кофермент, а активность протеидов наблюдается только в том случае, когда белковый компонент связан с апоферментом. Каталитическая активность фермента зависит не от всей молекулы, а только от активного центра. Его строение соответствует химической структуре катализируемого вещества по принципу «ключ-замок», поэтому действие ферментов строго специфично. Функции сложных белков заключаются как в участии в метаболических процессах, так и в использовании их в качестве акцепторов.
Разнообразие простых белков
Эта группа полипептидов немногочисленна. Их молекулы состоят только из аминокислотных остатков. К протеинам относятся, например, гистоны и глобулины. Первые представлены в структуре ядра и объединены с молекулами ДНК. Вторая группа — глобулины — считаются главными компонентами плазмы крови. Такой белок, как гамма-глобулин, выполняет функции иммунной защиты и является антителом. Эти соединения могут образовывать комплексы, в состав которых входят сложные углеводы и белки. Такие фибриллярные простые белки, как коллаген и эластин, входят в состав соединительной ткани, хрящей, сухожилий, кожи. Их главные функции — строительная и опорная.
Белок тубулин входит в состав микротрубочек, которые являются компонентами ресничек и жгутиков таких одноклеточных организмов, как инфузории, эвглены, паразитические жгутиконосцы. Этот же белок входит в состав многоклеточных организмов (жгутики сперматозоидов, реснички яйцеклеток, реснитчатый эпителий тонкого кишечника).
Белок альбумин выполняет запасающую функцию (например, белок куриных яиц). В эндосперме семян злаковых растений – ржи, риса, пшеницы — накапливаются молекулы белков. Они называются клеточными включениями. Эти вещества использует зародыш семени в начале своего развития. Кроме того, высокое содержание белка в зерновках пшеницы является очень важным показателем качества муки. Хлеб, испеченный из муки богатой клейковиной, имеет высокие вкусовые качества и более полезен. Клейковину содержат так называемые твердые сорта пшеницы. В плазме крови глубоководных рыб содержатся белки, препятствующие их гибели от холода. Они обладают свойствами антифриза, предотвращая гибель организма при низких температурах воды. С другой стороны, в составе клеточной стенки термофильных бактерий, живущих в геотермальных источниках, содержатся белки, способные сохранять свою природную конфигурацию (третичную или четвертичную структуру) и не денатурировать в интервале температур от +50 до + 90 °С.