Мутации ras
Содержание:
Что такое мутационная изменчивость
Определение
Изменчивость, образованная в результате изменений генотипа под влиянием факторов внешней или внутренней среды, называется мутационной.
Мутационная изменчивость вызвана воздействием на организм мутагенов, приводящие к специфическим изменениям, т.е. реорганизации репродуктивного строения клетки.
Мутационную теорию разработал в 1901-1903 гг. голландский ботаник Гуго Де Фриз. Сущность концепции заключалась в следующем:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
- Мутации образуются случайно в качестве дискретных изменений признаков.
- Они передаются в последующие поколения, в чем заключается их отличие от ненаследственных изменений.
- Изменения бывают вредными и полезными, доминантными и рецессивными.
- Обнаружить их можно при исследовании значительного количества особей.
- Они носят спонтанный характер: склонность к ним имеет любой участок хромосомы.
- Сходные мутации могут образоваться повторно.
Генотипическая, т.е. наследственная изменчивость является основой для возникновения разнообразных индивидуальных отличий, включающих в себя:
- качественные различия, не взаимосвязанные друг с другом, а также количественные различия, которые образуют непрерывные ряды, где близко расположенные элементы минимально отличаются друг от друга;
- изменения конкретного признака (независимая изменчивость) или изменения ряда черт (коррелятивная изменчивость);
- изменения с приспособительным значением, т.е. адаптивные, и «безразличные» — неадаптивные, способные снизить жизнеспособность носителя.
Каждый тип наследственных мутаций представляет собой эволюционный процесс.
Примечание
В отдельном организме наследственные признаки определяются не только теми генами, которые за них ответственны, но и характером взаимодействия с другими генами, входящих в генотип. Также учитываются внешние условия, в которых находился организм в процессе своего развития.
Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Самым известным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS. Доказано, что активация KRAS за счет мутации сводит на нет эффект ингибирования EGFR моноклональными антителами. Таким образом, наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому панитумумаб и цетуксимаб назначают только больным мКРР с диким типом гена KRAS.
Влияние дополнительных мутаций гена KRAS и новых мутаций гена NRAS, а также мутаций гена BRAF на эффективность таргетной терапии ингибиторами EGFR изучалось в исследованиях с панитумумабом и цетуксимабом пациентов мКРР:
- Анализ мутаций генов KRAS/NRAS и мутации гена BRAF в исследовании 3 фазы PRIME: комбинации панитумумаб+FOLFOX4 в сравнении с FOLFOX4 в 1-й линии терапии метастатического колоректального ракаOliner K, Douillard JY, Siena S, et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). ASCO 2013 (poster discussion): 3511
- Анализ мутаций генов RAS/RAF в исследовании 2 фазы PEAK: комбинации панитумумаба с mFOLFOX6 в сравнении с бевацизумабом в комбинации с mFOLFOX6 в 1-й линии терапии пациентов с метастатическим колоректальным раком с WTKRASSchwartzberg LS, Rivera F, Karthaus M, et al. PEAK (study 20070509): A randomized phase II study of mFOLFOX6 with either panitumumab (pmab) or bevacizumab (bev) as first-line (tx) in patients (pts) with unresectable wild type (WT) KRAS metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 30 (Suppl 34): 446
- Анализ влияния мутаций генов семейства RAS (2 экзона KRAS и других RAS-мутаций) в исследовании CRYSTAL: комбинации цетукпсимаба с FOLFIRI в сравнении с FOLFIRI в 1-й линии терапии пациентов с метастатическим колоректальным раком на выживаемость пациентов без прогрессии и общую выживаемостьVan Cutsem et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1; 33(7): 692-700
Все исследования показали, что, несмотря на то, что индивидуализация терапии антителами по статусу генов семейства RAS предусматривает сужение круга пациентов (примерно 50/50 вместо 60/40 при отборе только лишь по статусу 2 экзона гена KRAS), пациенты с диким типом генов KRAS и NRAS в опухоли получат максимальную пользу от терапии антителами в комбинации со стандартной химиотерапией, по сравнению с пациентами без мутаций гена KRAS во 2 экзоне. Пока нет достаточных доказательств негативного влияния мутаций генов BRAF, PI3K, PTEN и других участников сигнального пути RAS-RAF-MEK-ERK-МАРК по результатам крупных проспективных рандомизированных исследований, однако не исключено, что появление таких исследований вновь существенно изменит наши представления о группе пациентов, для которых применение анти-EGFR антител окажется наиболее выгодным.
В связи с этим целью программы является максимально широкое внедрение генетического тестирования при колоректальном раке в ежедневную практику онкологов, как одного из важнейших условий проведения современной эффективной терапии у целевой группы пациентов.
Список литературы:
- Heldin CH. Dimerization of cell surface receptors in signal transduction. Cell 1995; vol.80, no.2, pp.213-223.
- Carpenterand G, Cohen S. Epidermal growth factor. J Biol Chem, 1990; vol.265, no.14, pp.7709-7712.
- Citri A, Yarden Y. EGF-ERBB signalling: towards the systems level. Nature Rev Molecular Cell Biol 2006; vol.7, no.7, pp.505-516.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993; 366: 643-654.
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011; 223: 219-229.
- Edkins S, O’Meara S, Parker A, et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5: 928-932.
- Janakiraman M, Vakiani E, Zeng Z, et al. Genomic and biological characterization of exon 4 KRAS mutations in human cancer. Cancer Res 2010; 70: 5901-5911.
- Soh J, Okumura N, Lockwood WW, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PLoS One. 2009, 14, no.4(10). P.7464.
Войтив базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Регистрацияв программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Мутации
Все изменения последовательности нуклеотидов в ДНК, независимо от локализации и влияния на жизнеспособность клетки, – мутации. Нейтральные мутации или полиморфизмы – последовательности ДНК, не приводящие к заметным нарушениям функций.
Существуют две классификации мутаций (Strachan T., Read A., 2003). Одна базируется на функциональной характеристике и не рассматривает характер самой мутации. Вторая классифицирует мутации по структурным изменениям в ДНК и РНК.
Функциональная классификация подразделяет мутации:
- связанные с потерей функции белка;
- связанные с приобретением новой аномальной функции белка;
- в регуляторных областях гена, приводящие к количественным изменениям первичного белкового продукта.
Структурная классификация выделяет следующие типы:
- нонсенс-мутация – изменение в нуклеотидной последовательности ДНК кодирующей области гена, приводящее к возникновению стоп-кодона и преждевременному прекращению синтеза белка;
- миссенс-мутация – изменение в нуклеотидной последовательности ДНК кодирующей области гена, приводящее к изменению одной аминокислоты, что не нарушает процесс синтеза белка;
- мутации, приводящие к сдвигу рамки считывания белка и возникновению стоп-кодона на некотором расстоянии от самой мутации, что приводит к преждевременной терминации синтеза белка. Мутации сдвига рамки считывания вызываются делециями и инсерциями, не кратными трем (кодон = 3) нуклеотидам;
- мутации в сайтах сплайсинга приводят к тому, что нарушается процессинг мРНК, что ведёт к: а) делеции всего или части экзона; б) обычно удаляемые интронные области могут стать смысловыми. Такая патология приводит к сдвигу рамки считывания и появлению стоп-кодона. В результате белковый продукт гена не только укорачивается, но и может оказаться совершенно аномальным.
Для злокачественных опухолей характерны все типы мутаций. Высокоинформативными структурными ДНК-маркерами, позволяющими проводить раннюю диагностику опухолевого процесса, определять прогноз развития заболевания и подбирать наиболее эффективные варианты терапии, являются характерные нарушения нуклеотидной последовательности белок-кодирующих генов в некоторых типах опухоли.
ДНК-диагностика мутаций может быть косвенной и прямой (Strachan T., Read A., 2003).
При прямой диагностике предметом анализа являются мутации гена. Прямые методы возможны лишь при наличии информации об экзон-интронной организации или полноразмерной нуклеотидной последовательности ДНК гена.
ПЦР с использованием определенного фермента гидролиза ДНК возможна при стандартной мутации с изменением сайта рестрикции, если без изменения сайта рестрикции – аллель-специфическая ПЦР.
Определение нуклеотидной последовательности фрагмента ДНК, показавшего аномальную электрофоретическую подвижность, и заключительным этапом анализа мутаций является их секвенирование. Прямое секвенирование позволяет с 100% эффективностью определить мутацию.
В косвенной диагностике мутаций используются несколько методов. Наиболее просто при электрофоретическом анализе обнаруживаются мутации, изменяющие длину амплифицированных фрагментов ДНК.
Для выявления точковых мутаций, небольших делеций и инсерций в исследуемых генах используется множество различных подходов, основанных на методе полимеразной цепной реакции. При ПЦР возможно многократно увеличить уникальную последовательность ДНК, а затем проанализировать её на наличие мутации.
Метод конформационного полиморфизма однонитевой ДНК (SSCP) – один из наиболее простых в исполнении высокочувствительных методов поиска однонуклеотидных замен в исследуемом участке геномной ДНК. Оптимальный размер исследуемого фрагмента ДНК 200-250 п.н., при котором вероятность обнаружения мутаций составляет 70-95%.
Вероятность идентификации точковых мутаций методом гетеродуплексов достигает 80-90% при длине фрагментов ДНК не более 300 п.н. Метод основан на том, что за счет конформационных особенностей в местах несовпадения нуклеотидов электрофоретическая подвижность гетеродуплексов, образующихся при комплиментарном взаимодействии мутантной и нормальной ДНК отличается от подвижности гомодуплексов нормальных фрагментов ДНК.
Наиболее распространенным способом скрининга мутаций, позволяющим выявить точковые мутации почти в 100% случаев и не требующим больших затрат времени, считается комбинация анализа гетеродуплексов и метода однонитевого конформационного полиморфизма.
Виды
Возникновению мутаций способствуют различные факторы. На основании этого различают следующие их виды:
Генные
Связаны с изменением строения одного гена. Данный характер изменений затрагивает в результате нарушений при репликации (удвоении) последовательность нуклеотидов. Различают следующие их разновидности:
- инсерции (вставка молекул ДНК в ген);
- инверсия (поворот фрагмента ДНК на 180 градусов);
- дупликация (удвоение сегмента ДНК);
- деления (утрата сегмента ДНК).
Пример: развитие заболевания серповидноклеточной анемии.
Хромосомные
Происходящие изменения затрагивают строение хромосом. Различают их:
- перенос;
- поворот на 180 градусов;
- удвоение;
- выпадение участка хромосомы.
Причиной появления таких мутаций является сбой в работе кроссинговера.
Пример: рождение детей с синдромом «кошачьего крика».
Геномные
Возникают вследствие изменения хромосом. К примеру, развитие у растений полиплоидии (кратного увеличения хромосом). Полиплоидию вызывают нарушения хода мейоза и митоза. Именно геномные мутации приводят к возникновению различных форм рака. Геномные мутации появляются вследствие нарушения процесса расхождения хромосом.
Пример: увеличение в геноме человека числа хромосом на 1 единицу (47 вместо положенных 46) приводит к развитию синдрома Дауна.
Соматические
Мутированию подвержены и соматические клетки. Не передаются по наследству при половом процессе, но наследуются вегетативно у растений и почковании у кишечнополостных.
Пример: появление белой пряди волос.
Цитоплазматические
Происходящие изменения затрагивают ДНК, находящуюся в пластидах и митохондриях. Такие мутации передаются только у женщин из-за того, что из сперматозоидов пластиды с митохондриями не проникают внутрь зиготы.
Пример: пестролистность у растений.
Мутация генов
Генные мутации – это наиболее распространённый тип наследственной изменчивости, они связаны с деформацией первичной структуры ДНК в пределах одного гена, происходят на молекулярном уровне организации живого. Возникают они в процессе удвоения ДНК. Происходит это нечасто, примерно одна мутация на 10-100 тыс. копий. Но в генотипах они постепенно накапливаются, создавая разнообразие всего живого. Именно благодаря таким мутациям возникли разные аллели одного гена.
Мутация, при которой изменяется одна пара оснований, называется точечной или однонуклеотидной. Нуклеотид может быть заменён на другой, добавлен или удалён.
Мутация: замена азотистых оснований
Замена одной пары оснований в ДНК на другую называется мутацией замещения. Из-за вырожденной природы генетического кода замена основания может не привести к замещению закодированной аминокислоты. Если окажется, что новый триплет кодирует ту же аминокислоту, то мутация будет молчащей.
Часто при замене основания меняется кодируемая аминокислота в белке, получаемом при транскирипции мутантного гена. Замены делятся на две группы:
- транзакции;
- трансверсии.
Транзакция не заменяет типа оснований в гене, пиримидин замещается пиримидином, а пурин – пурином. Напротив, трансверсия изменяет тип оснований в паре (приримидин – пурин). Различные заболевания вызваны трансверсией, в том числе серповидно-клеточная анемия.

Бессмысленные (нонсенс-мутации)
Особая категория замены оснований вызывает смену транскрибируемого (кодирующего белок) кодона в стоп-кодон. Он приводит к преждевременному прекращению трансляции и к усечению белка. Насколько коротким получится белок зависит от того, где в гене установится стоп-кодон.
Может быть и наоборот, когда стоп-кодон в результате мутации становится активным геном и способствует синтезированию необычно длинных молекул белка.
Мутация сдвига рамки считывания
Добавление или удаление пары комплементарных оснований имеет гораздо большие последствия, чем замена одного основания на другое. Такие нарушения сдвигают рамки считывания в мРНК ниже от мутации. Это связано с тем, что считывание информации происходит триплетами без знаков препинания внутри тройки. Обычно такие мутации приводят к полному выключению функционирования гена. Этот тип деформаций был использован Криком и Бреннером для того, чтобы сделать вывод о триплетной природе генетического кода.
Изменение рамки считывания в гене на ранней стадии означает изменение части белка. Смена кадров также может привести к преждевременному завершению транскрипции, так как 3 из 64 кодонов являются стоп-кодонами.
Генная мутация: удвоение триплета
Учитывая долгую историю молекулярной генетики и относительно короткое время молекулярного анализа у человека, удивительно, что новый вид мутации был обнаружен у людей.
Один из первых генов, связанных с нарушением у человека – болезни Хантингтона – был мутантным. При этом ген, кодирующий белок хантингтин, содержит повторяющийся триплет. Болезнь Хантингтона — дегенеративное расстройство нервной системы, которое приводит к совершению неконтролируемых движений, утрате интеллектуальных способностей и эмоциональному возбуждению. При болезни Хантингтона белок, кодируемый мутировавшим геном, убивает нервные клетки в определённых частях мозга, следствием чего становится гибель нервов, которые регулируют движения.
Болезнь Хантингтона обнаруживается во взрослом возрасте (в то время как остальные генетически обусловленные болезни обычно проявляются в детстве), и поэтому те, кто болен ею, часто успевают произвести на свет детей. Мутация гена, обуславливающая болезнь Хантингтона, передается как через мужские, так и через женские хромосомы, и поэтому существует очень большая вероятность, что ребёнок обязательно унаследует заболевание от больного родителя.
Теперь известно не менее 20 заболеваний, связанных с такой мутацией. Такой тип аномалий пока был найден только у людей и мышей. Предполагают, что он характерен только для позвоночных или даже исключительно для млекопитающих. Например, у дрозофилы её не обнаруживали никогда.
Расширение триплета может происходить в области кодирования или транскрибирования. В случае болезни Хантингтона единица повтора находится в кодирующей области триплета, кодирующего глутамин, и расширение приводит к полиглутаминовой области в белке. В случае синдрома Мартина-Белла наследственная форма умственной отсталости вызвана повтором в некодирующей части ДНК.
Нарушение систем передачи сигнала и канцерогенез
RAS-белки часто упоминают как протоонкогенные продукты: их постоянная активация ведет к злокачественному перерождению клеток. Характерный механизм перерождения RAS – точечные мутации в соответствующих генах. Наиболее частыми онкогенными мутациями генов всего семейства RAS являются мутации в 12 и 61 кодонах.
Мутации в гене KRAS в опухолях толстой кишки встречаются в 30-60% случаев. Наиболее часто мутации KRAS определяются в экзоне 2, кодонах 12 и 13. Однако описаны мутации в экзоне 3, кодоне 61, и в экзоне 4, кодонах 117 и 146. Мутации в гене NRAS (в идентичных экзонах и кодонах) при КРР составляют до 5%. Мутации в гене HRAS при аденокарциноме толстой кишки не описаны.
Мутации генов семейства RAS при злокачественных опухолях(по базе данных COSMIC)
| Орган | Тип опухоли | Мутации (%) | ||
|---|---|---|---|---|
| HRAS | KRAS | NRAS | ||
| Колоректальный рак | Аденокарцинома | 42 | 5 | |
| Желчные пути | Аденокарцинома | 35 | 2 | |
| Мочевой пузырь | Уротелиальная карцинома | 12 | 4 | 2 |
| Печень | Гепатоцеллюлярный рак | 4 | 4 | |
| Легкое | Крупноклеточный рак | 4 | 21 | 4 |
| Аденокарцинома | 16 | 1 | ||
| Поджелудочная железа | Протоковая аденокарцинома | 69 | 1 | |
| Эндокринные опухоли | 1 | 75 | ||
| Кожа | Меланома | 1 | 2 | 20 |
Виды мутаций
Мутации происходят не по какой-то одной причине. Это целый процесс, который становится возможным на клеточном уровне организма. К настоящему времени ученые выделяют 4 основных вида мутаций:
- Генные;
- Хромосомные;
- Геномные;
- Цитоплазматические.
Ученые пришли к выводу, что большинство из мутаций вредны, и природа устроена так, что из-за естественного отбора они исчезают у людей самостоятельно. Однако выделяют и такие мутации, которые повышают жизнеспособность организма. Тем более некоторые изменения генов могут быть вредны в одних условиях окружающей среды, но при этом полезны в других.
Различают два подвида мутаций:
- Спонтанные
- Индуцированные
Спонтанные мутации возникают случайно — например, если в стаде овец внезапно родилась овца с более короткими ногами. Или появление черной зебры среди обычных, кошек с белыми лапами и так далее. Спонтанные мутации бывают и у человека, причем вы можете даже не знать о том, что в вашем организме происходят какие-то изменения. Они чаще всего носят «косметический» характер и представляют собой изменение комбинации генов.
Появление черной зебры сначала посчитали аномалией и даже связали с религией
Индуцированные мутации являются «искусственными» и возникают под воздействием химических веществ, различных излучений, биологических объектов, например, вирусов. Да, именно такие мутации есть у большинства супергероев из комиксов — от «Человека-паука» до «Росомахи» (ну или «Дедпула», раз уж на то пошло).
Индуцированные мутации в кино дают супергероям сверхспособности
Генные мутации
При таком виде мутаций, как правило, затрагивается только один конкретный ген. Генные мутации возникают как при замещении одного гена другим, так и при выпадении какого-то гена из общей цепочки или при перевороте участка молекулы ДНК, который затрагивает один ген.
При генной мутации происходит изменение только одного гена
Подобные мутации могут быть как спонтанными, так и индуцированными: например, та же черная зебра стала такой, потому что ген, отвечающий за изменение ее цвета, был заменен другим по естественной причине. Также генные мутации возникают при облучении, контакте с химическими веществами или вирусами.
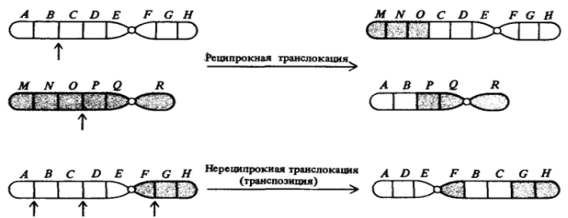
Хромосомные мутации
При хромосомных мутациях затрагивается не один ген, а несколько. Такие мутации гораздо более опасные, чем просто генные: если изменению подвержено слишком много генов, клетка уже не может делиться и начинает самоуничтожаться. Известны случаи, когда некоторые люди и животные погибали из-за таких мутаций, поскольку хромосомы в их клетках утрачивались или удваивались, что приводило к нарушению обменных процессов в организме.
Хромосомные мутации затрагивают сразу несколько генов
При хромосомных мутациях возможно как выпадение участка хромосомы, так и удвоение хромосомы, поворот участка хромосомы на 180 градусов или даже ее перемещение в другое место. Это приводит к болезням Прадера-Вилли (ожирение, низкий рост и интеллект одновременно) и Вольфа-Хиршхорна (задержка умственного развития).
Делеция – выпадение участка хромосомы
Дупликация – удвоение какого-то участка хромосом
Инверсия – поворот участка хромосомы на 180 градусов
Транслокация – перемещение какого либо участка хромосомы
Геномные мутации
Этот вид мутаций еще страшнее, поскольку затрагивает не один или несколько генов, а целый геном. Геномный вид мутаций возникает в следствие ошибок при расхождении хромосом. Причем он довольно интересный: если изменение хромосом кратное, то в организме увеличиваются клетки и внутренние органы — такие мутации ученые ранее наблюдали у некоторых растений и животных.
Кукуруза растет благодаря геномной мутации
Однако если количество хромосом меняется не кратно, в организме происходят отрицательные процессы. К примеру, для человека характерна мутация трисомия 21: в этом случае не расходится двадцать первая пара хромосом, в результате ребенок получает не две двадцать первые хромосомы, а три. Это приводит к развитию синдрома Дауна, в результате чего ребенок получается умственно и физически неполноценным.
Цитоплазматические мутации
Они возникают вследствие нарушения ДНК митохондрий, из которых состоят клетки. Это одни из самых редкий мутаций, которые еще слабо изучены. Однако ученые уже пришли к выводу, что цитоплазматические мутации приводят к нарушению зрения и проблемам с центральной нервной системой. Есть теория, что данный вид мутаций также отвечает за появление сахарного диабета.
Сложность в том, что каждая опухоль уникальна по своему набору «мишеней»-мутаций
Так же, как уникален код ДНК у каждого человека — неповторимы и опухоли. Ведь они «рождены» из собственных клеток организма. Не существует опухолей с одинаковыми генно-молекулярными свойствами. Поэтому создать универсальную «таблетку» от рака — принципиально невозможно. Рак — слишком индивидуальное заболевание.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
Чтобы эффективно использовать таргетную терапию, этого мало. Врач должен знать, какие мутации есть в опухолевых клетках у конкретного пациента, присутствуют ли в них биомаркеры-«мишени» для того или иного препарата. Персонализированная медицина, как она есть.
Для этого мы и применяем молекулярно-генетические исследования. Чтобы найти «мишени», по которым нужно прицельно бить таргетными и иммунотреапевтическими препаратами — нужно определить, из каких генов собрана ДНК опухоли, и какие гены в ней — «сломаны». В результате:
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Там из образца выделяют опухолевую ДНК и секвенируют ее. То есть — «прочитывают» последовательность «букв»-нуклеотидов. А затем сравнивают с диагностической панелью, отобранной из базы библиотек — уже расшифрованных геномов тысяч других людей. Панель подбирают под каждого пациента — с учетом анамнеза и клинических данных. Все это, разумеется, делают автоматические секвенаторы и компьютер.
И если 20 лет назад «чтение» генома занимало месяцы, требовало медленной и сложной расшифровки, то сегодня в лаборатории, с которой мы сотрудничаем, делают анализ за несколько рабочих дней.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.