Таргетная терапия
Содержание:
- Кейтруда (Пембролизумаб)
- Побочные эффекты иммунотерапии
- Режим дозирования
- Побочные действия
- Что такое химиотерапия?
- Особые указания
- Таргетная терапия рака
- Показания к применению
- Медикаменты при таргетной терапии рака
- Виды мутаций
- Таргетная терапия гормонально-позитивного рака молочной железы
- Механизм действия
- В каких случаях при раке почек назначают таргетную терапию?
- Фармакокинетические свойства
- Как это происходит
- Факторы, стимулирующие ангиогенез
- Какие препараты применяют?
- Почему на некоторые виды таргетной терапии цены очень высокие?
Кейтруда (Пембролизумаб)
Побочные эффекты иммунотерапии
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Иногда иммунотерапия активирует иммунные клетки чрезмерно, и они начинают атаковать нормальные ткани организма. Из-за этого могут возникать некоторые побочные эффекты:
- При поражении слизистой оболочки полости рта и глотки на ней возникают болезненные язвы, которые могут инфицироваться. Обычно они проходят в течение 5–14 дней после окончания лечения.
- Кожные реакции: покраснение, отечность, сухость, повышение чувствительности к свету, трещины на кончиках пальцев.
- Симптомы, напоминающие грипп: слабость, разбитость, повышенная температура, озноб, кашель.
- Тошнота и рвота.
- Головные боли, головокружения.
- Повышение или снижение артериального давления.
- Мышечные боли.
- Одышка.
- Отеки на ногах.
- Увеличение веса из-за задержки жидкости в организме.
- Диарея.
У разных иммунопрепаратов побочные эффекты выражены по-разному. Лучше заранее поговорить с врачом и спросить, каких проблем можно ожидать во время курса лечения, как с ними бороться.
Режим дозирования
Побочные действия
Поскольку пертузумаб используется только в комбинации с другими препаратами, сложно установить влияние каждого отдельного препарата на развитие того или иного осложнения. Тем не менее, таковые имели место быть.
Наиболее частые осложнения, которые развивались более чем у 30% больных:
- Диарея.
- Выпадение волос.
- Тошнота.
- Упадок сил.
- Рвота.
- Снижение количества лейкоцитов.
- Тяжелая нейтропения с повышением температуры наблюдалась у 10% пациенток. Были даже зафиксированы летальные случаи.
Очень частые осложнения, которые встречались более чем в 1/10 случаев:
- Анемии.
- Инфузионные реакции.
- Нарушение аппетита, искажение вкусового восприятия.
- Бессонница.
- Головная боль, головокружение.
- Парестезии и периферические нейропатии.
- Слезоточивость.
- Кровотечения (в основном носовые).
- Кашель.
- Одышка.
- Стоматиты.
- Запоры.
- Сыпь.
- Кожный зуд.
- Поражение ногтей.
- Вагиниты.
- Риниты.
- Отеки.
- Боли различной локализации, в том числе мышцах и суставах.
Частые осложнения, которые развивались менее чем в 1/10 случаев и более чем в 1/100 случаев:
- Реакции гиперчувствительности.
- Нарушение функции левого желудочка.
- Паронихии.
- Инфекции ВДП (верхних дыхательных путей).
- Озноб.
Что такое химиотерапия?
Часто для лечения онкопатологии используются химиопрепараты — вещества способные уничтожать опухолевые клетки. Химиопрепараты могут быть в виде раствора для внутривенного или внутримышечного введения, или в виде капсул и таблеток для приема внутрь. В зависимости от варианта заболевания, состояния пациента и других факторов может использоваться один препарат (монохимиотерапия) или несколько (полихимиотерапия). Обычно химиотерапия проводится циклами, т.е. несколько дней введения препарата чередуются с периодом «отдыха». Количество таких циклов зависит от вида патологии, переносимости лечения и некоторых других факторов. После нескольких циклов (обычно после 2 — 4 циклов) проводится обследование для определения эффективности лечения. Эффективность проводимой терапии зависит от вида и особенности опухоли, а также от соблюдения схемы лечения.
Говоря о химиотерапии необходимо отметить, что, к сожалению, химиопрепараты, как и другие лекарства, обладают побочными эффектами, проявления которых варьируются в зависимости от используемых схем лечения и особенностей организма пациента. Однако сегодня существуют специальные препараты, способные значительно снизить нежелательные последствия химиотерапии. Они в обязательном порядке применяются у всех пациентов в нашей клинике. Вся терапия в нашем центре проводится в комфортабельных одноместных или двухместных палатах, что обеспечивает психологический и физический комфорт, улучшая переносимость лечения.
Особые указания
Препарат применяется только после лабораторного подтверждения гиперэкспрессии HER-2.
В медицинских документах больного необходимо указывать торговое наименование препарата и его серийный номер.
Инфузия должна осуществляться при наличии доступа к набору оказания экстренной помощи и врача, имеющего опыт химиотерапевтического лечения.
Необходима осторожность при применении пертузумаба у пациентов с нарушением ФВЛЖ. До начала терапии им проводят исследование функции ФВЛЖ, а затем ее регулярный мониторинг
При ухудшении состояния, лечение отменяют до стабилизации.
Инфузионные реакции
В эту группу реакций было отнесено повышение температуры тела, озноб, упадок сил, рвота, головная боль. При развитии таких реакций, необходимо уменьшить скорость введения препарата и даже прервать его, если потребуется. Наблюдение за пациенткой устанавливается до устранения симптомов. При хорошей переносимости препаратов, пациентка должна находиться под наблюдением медперсонала на протяжении всей инфузии и в течение часа (в случае первого введения препарата) или получаса (при повторных кусах).
При развитии тяжелых инфузионных реакций рассматривается вопрос об отмене данного вида противоопухолевого лечения.
Реакции гиперчувствительности и анафилаксии
Наблюдались случаи летального исхода после анафилактической реакции на пертузумаб. В этой связи препарат вводится только при доступности аптечки экстренной помощи. При развитии анафилаксии, помощь необходимо начать оказывать немедленно. Дальнейшее лечение пертузумабом противопоказано.
Фебрильные нейтропении
Фебрильная нейтропения может развиться у пациентов, принимающих таргетную терапию совместно с доцетакселом. Наиболее высокие риски в течение первых 3 курсов. Чаще всего данное осложнение развивалось у больных на фоне диареи и мукозита. В этой связи рекомендуется симптоматическое лечение данных явлений.
Таргетная терапия рака
О методике
Среди основных лечебных направлений в клинике Onco.Rehab особое место занимает метод медикаментозного лечения таргетная терапия рака. Само название метода восходит к английскому «target», что означает «цель». Это вполне отражает суть метода.
Таргетная терапия рака является современным методом, который используется для борьбы с раковыми клетками, нередко на полное избавление от них. При этом здоровые ткани не страдают, что, в свою очередь, минимизирует риск возникновения побочных эффектов.
Применение таргетной терапии рака как составляющего элемента интегративной онкологии в клинике Onco.Rehab показывает положительные результаты, улучшает состояние пациентов, продлевает их жизнь.
Методика может использоваться и как самостоятельная процедура, но именно при комплексном воздействии на пораженные клетки она наиболее эффективна.
Таргетная терапия рака включает в себя 3-6 курсов, каждый по 21 дню. В период лечения пациент должен соблюдать диету, это повышает положительный прогноз на контролирование роста клеток опухоли.
Показания к применению
Выбор метода лечения рака зависит от ряда факторов. Показаниями для применения таргетной терапии рака могут быть:
- Тяжёлое состояние пациента, при котором невозможно хирургическое вмешательство и недопустима химиотерапия, так как это только ухудшит его самочувствие;
- Использование мощных препаратов, которые могут негативно воздействовать на здоровые ткани;
- Большой риск распространения метастазов, а также большая вероятность рецидива;
- Быстрое размножение раковых клеток, затрагивающих новые органы;
- Ускоренные темпы роста опухоли.
Онкологический центр
В медицинской практике используются разные виды таргетной терапии рака, выделяются дополнительные подгруппы. Каждый вид имеющихся в арсенале врача препаратов направлен на выполнение определённых действий. Посредством препаратов происходит «доставка» молекул токсических веществ к патогенным клеткам и происходит их уничтожение.
Медикаменты при таргетной терапии рака
Главные преимуществами методики признаются:
- Минимальное воздействие на организм пациента;
- Избирательность используемого препарата на клетки мишени;
- Высокая уникальность.
Учитывая механизм действия используемых препаратов при таргетной терапии рака, выделяют несколько их групп:
Группа первая – моноклональные антитела. Препараты, относящиеся к этой группе, функционируют на уровне сосудистого роста и рецепторов клеток. Это синтетические белки, которые содержат антитела к выбранным мишеням в генах новообразования. В этой группе – Трастузумаб, Бевацизумаб, Панитумумаб и другие препараты, названия действующего вещества которых оканчиваются на «маб».
Группа вторая – ингибиторы тирозинкиназ. Они представляют собой внутриклеточные белки, которые должны обеспечивать связь клетки с клеточными структурами и с самим ядром клетки. В данной группе – Гефитиниб, Эрлотиниб и другие препараты, названия действующего вещества которых оканчиваются на «иб».
И, наконец, группа третья – противоопухолевые иммунодепрессанты. Их задача – блокировать сигнал к делению и росту клетки. В данной группе – Эверолимус и другие препараты, названия действующего вещества которых оканчиваются на «ус».
Лекарство при таргетной терапии рака проникает в определённый орган и оказывает на него терапевтическое воздействие. Препараты, относящиеся к таргетной линейке, имеют узкую направленность.
Так нельзя использовать препарат, предназначенный для борьбы с раком легких для лечения рака молочной железы. Результата не будет, но проявятся побочные эффекты.
Рак кишечника, прямой кишки успешно лечится с помощью таргетных препаратов в моно-режиме и в виде комплексного воздействия. При лечении саркомы направленность препаратов – на повреждение биологической структуры образования.
Схема лечения пациентов клиники интегративной онкологии Onco.Rehab, количество необходимых процедур подбираются индивидуально, в зависимости от диагноза больного и только после предварительной консультации.
Записаться на прием к врачу-онкологу Вы можете на нашем сайте.
Виды мутаций
Мутации происходят не по какой-то одной причине. Это целый процесс, который становится возможным на клеточном уровне организма. К настоящему времени ученые выделяют 4 основных вида мутаций:
- Генные;
- Хромосомные;
- Геномные;
- Цитоплазматические.
Ученые пришли к выводу, что большинство из мутаций вредны, и природа устроена так, что из-за естественного отбора они исчезают у людей самостоятельно. Однако выделяют и такие мутации, которые повышают жизнеспособность организма. Тем более некоторые изменения генов могут быть вредны в одних условиях окружающей среды, но при этом полезны в других.
Различают два подвида мутаций:
- Спонтанные
- Индуцированные
Спонтанные мутации возникают случайно — например, если в стаде овец внезапно родилась овца с более короткими ногами. Или появление черной зебры среди обычных, кошек с белыми лапами и так далее. Спонтанные мутации бывают и у человека, причем вы можете даже не знать о том, что в вашем организме происходят какие-то изменения. Они чаще всего носят «косметический» характер и представляют собой изменение комбинации генов.

Появление черной зебры сначала посчитали аномалией и даже связали с религией
Индуцированные мутации являются «искусственными» и возникают под воздействием химических веществ, различных излучений, биологических объектов, например, вирусов. Да, именно такие мутации есть у большинства супергероев из комиксов — от «Человека-паука» до «Росомахи» (ну или «Дедпула», раз уж на то пошло).

Индуцированные мутации в кино дают супергероям сверхспособности
Генные мутации
При таком виде мутаций, как правило, затрагивается только один конкретный ген. Генные мутации возникают как при замещении одного гена другим, так и при выпадении какого-то гена из общей цепочки или при перевороте участка молекулы ДНК, который затрагивает один ген.

При генной мутации происходит изменение только одного гена
Подобные мутации могут быть как спонтанными, так и индуцированными: например, та же черная зебра стала такой, потому что ген, отвечающий за изменение ее цвета, был заменен другим по естественной причине. Также генные мутации возникают при облучении, контакте с химическими веществами или вирусами.
Хромосомные мутации
При хромосомных мутациях затрагивается не один ген, а несколько. Такие мутации гораздо более опасные, чем просто генные: если изменению подвержено слишком много генов, клетка уже не может делиться и начинает самоуничтожаться. Известны случаи, когда некоторые люди и животные погибали из-за таких мутаций, поскольку хромосомы в их клетках утрачивались или удваивались, что приводило к нарушению обменных процессов в организме.
Хромосомные мутации затрагивают сразу несколько генов
При хромосомных мутациях возможно как выпадение участка хромосомы, так и удвоение хромосомы, поворот участка хромосомы на 180 градусов или даже ее перемещение в другое место. Это приводит к болезням Прадера-Вилли (ожирение, низкий рост и интеллект одновременно) и Вольфа-Хиршхорна (задержка умственного развития).
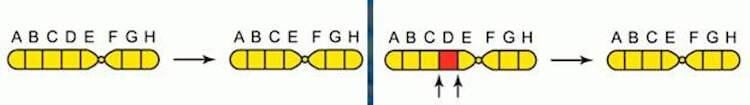
Делеция – выпадение участка хромосомы
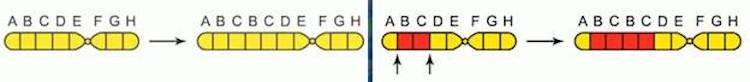
Дупликация – удвоение какого-то участка хромосом
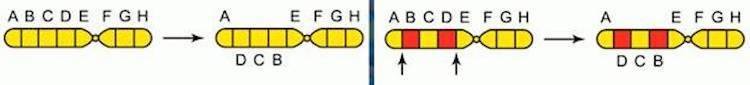
Инверсия – поворот участка хромосомы на 180 градусов
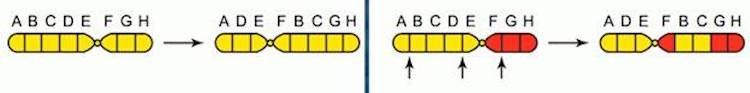
Транслокация – перемещение какого либо участка хромосомы
Геномные мутации
Этот вид мутаций еще страшнее, поскольку затрагивает не один или несколько генов, а целый геном. Геномный вид мутаций возникает в следствие ошибок при расхождении хромосом. Причем он довольно интересный: если изменение хромосом кратное, то в организме увеличиваются клетки и внутренние органы — такие мутации ученые ранее наблюдали у некоторых растений и животных.

Кукуруза растет благодаря геномной мутации
Однако если количество хромосом меняется не кратно, в организме происходят отрицательные процессы. К примеру, для человека характерна мутация трисомия 21: в этом случае не расходится двадцать первая пара хромосом, в результате ребенок получает не две двадцать первые хромосомы, а три. Это приводит к развитию синдрома Дауна, в результате чего ребенок получается умственно и физически неполноценным.
Цитоплазматические мутации
Они возникают вследствие нарушения ДНК митохондрий, из которых состоят клетки. Это одни из самых редкий мутаций, которые еще слабо изучены. Однако ученые уже пришли к выводу, что цитоплазматические мутации приводят к нарушению зрения и проблемам с центральной нервной системой. Есть теория, что данный вид мутаций также отвечает за появление сахарного диабета.
Таргетная терапия гормонально-позитивного рака молочной железы
В 60–70% случаев на поверхности опухолевых клеток при раке молочной железы присутствуют в большом количестве рецепторы к гормонам, которые способствуют их быстрому размножению. Эти злокачественные опухоли называются гормонально-позитивными. В таких случаях назначают гормональную терапию, но иногда могут быть полезны и некоторые таргетные препараты.
Палбоциклиб (Ибранса), Рибоциклиб (Кискали) и Абемациклиб (Верзенио)
Все три препарата блокируют ферменты циклин-зависимые киназы, которые обозначаются как CDK, а именно их варианты CDK4 и CDK6. Их принимают в виде таблеток один или два раза в день. Ингибиторы CDK4/6 могут замедлить размножение опухолевых клеток и затормозить прогрессирование заболевания при гормонально-положительномHER2-отрицательном раке груди.
Препараты из данной группы могут применяться по-разному, в сочетании с различными лекарственными средствами для гормональной терапии:
- У женщин, которые находятся в постменопаузе — в сочетании с ингибиторами ароматазы или Фулвестрантом.
- У женщин, у которых уже началась или скоро начнется менопауза, в сочетании с Фулвестрантом или ингибиторами ароматазы и аналогами гонадотропин-рилизинг-гормона, которые подавляют производство эстрогенов яичниками.
- Абемациклиб назначают женщинам, ранее получавшим лечение гормональными препаратами и химиопрепаратами.
Эверолимус (Афинитор)
Этот препарат блокирует белок mTOR, который находится внутри клеток и активирует их деление, а также подавляет рост новых кровеносных сосудов, кровоснабжающих опухолевую ткань. Выпускается в виде таблеток, предназначенных для приема один раз в день.
Обычно эверолимус назначают в сочетании с ингибиторами ароматазы женщинам в постменопаузе с прогрессирующим гормонально-позитивнымHER2-отрицательным раком молочной железы, после того как болезнь начала прогрессировать на фоне лечения летрозолом или анастрозолом.
Механизм действия
Иммуно-таргетная терапия, комбинированная программа имеет своей целью угнетение размножения злокачественных клеток. Биотерапия выигрывает минимальным влиянием на здоровые структуры. Это объясняется механизмом ее действия. Таргетная терапия (в отличие от классической химии) базируется на веществах, влияющих на молекулярные мишени — клетки, ответственные за рост опухоли.
Лекарства действуют только на клетки, содержащие специфические мишени. Они предупреждают деление клеток, не убивая их. Именно на этом делают акцент ученые, объясняя, чем отличается таргетная терапия от химиотерапии. Классические медикаменты убивают или сильно повреждают опухолевые клетки, в то время как препараты биотерапии ингибируют пролиферацию, сдерживая рост опухоли, уменьшая ее массу.
Таргетная терапия BRAF-ингибиторами, биологическая программа направлена на цели:
- рецепторы EGFR,
- сосудистые факторы VEGF;
- ответственные за митогенные сигналы белки;
- контролирующие клеточную смерть молекулы;
- гены, от которых зависит деление, клеточный рост.
Препараты таргетной терапии могут выключить гены за счет РНК-интерференции.
Таргетная терапия при раке молочной железы. Фото: 247doc.ru
При злокачественных процессах на мембранах клеток экспрессируются генные мутации, а сигнальные пути злокачественных формирований активируются нормальными и мутировавшими рецепторами. Механизм действия таргетной терапии следующий: работа внешних рецепторов контролируется моноклональными антителами, для угнетения внутренних сигнальных путей необходимы ингибиторы. Каждая молекула, попадая в организм, вступает в реакцию со специфичным рецептором, делая его неспособным реагировать на другие вещества.
Лечение таргетной терапией применяется с целями:
- стабилизация состояния опухоли;
- замедление процесса;
- перевод болезни из острой в хроническую форму;
- снижение объемов химиотерапии, лучевого лечения;
- предупреждение рецидива ракового процесса;
- контроль метастазов.
Показание таргетной терапии — борьба с раком при невозможности применения химиотерапии. Это необходимо, если больной находится в тяжелом состоянии или его возраст не допускает приема агрессивных препаратов.
Перед назначением программы проверяется чувствительность опухоли к медикаменту. Для этого проводятся иммуногистохимические, молекулярно-генетические исследования.
Еще один ограничивающий фактор — стоимость медикаментов. Доступна таргетная терапия по ОМС, но доступность лекарств зависит от больницы, региона, выделенных квот.
Это любопытно! Сложно сказать точно, сколько стоит таргетная терапия, но курс обойдется минимум в 100 000 рублей. Верхняя граница — порядка 800 000 рублей.
Биотерапия на примерах:
- HER2-позитивный рак молочной железы. На его долю приходится до трети всех онкологических болезней органа. Патологический клеточный рост связан с белком HER2. Направленная на него программа включает адотрастумумаб, лапатиниб.
- Онкология толстой кишки лечится антиангиогенным курсом. Назначают регорафениб, бевацизумаб. Можно комбинировать препараты с химиокурсом. Если анализы для таргетной терапии показали отсутствие мутации KRAS, показаны препараты, влияющие на белок EGFR.
- У каждого второго больного меланомой выявляется генная мутация BRAF. От анализов зависит, кому назначают таргетную терапию. При наличии мутации применяют вемурафениб, дабрафениб.
- Актуальна таргетная терапия в лечении лейкоза. Действенность некоторых средств достигает 100%. Назначают ABT199, ингибиторы IDH1 и IDH2.
Таргетная терапия (что это такое и последствия курса) — одна из частых тем медицинских семинаров в области онкологии в последние годы. Биологическое лечение считается самым перспективным. Курс, направленный на опасные клетки, практически не затрагивает здоровые структуры. Недостаток программы — недостаточная изученность. Известны побочные эффекты, долговременные негативные последствия лечения, но частота их возникновения сравнительно мала.
В каких случаях при раке почек назначают таргетную терапию?
Основное показание к назначению таргетных препаратов при злокачественных опухолях почек — неэффективность химиотерапии. Таргетная терапия часто применяется при запущенных злокачественных опухолях на поздних стадиях. Она не предназначена для того, чтобы вылечить рак, но может уменьшить размеры опухоли, замедлить ее рост — это помогает увеличить продолжительность жизни пациента.
Другая сфера применения таргетных препаратов при раке почки — в качестве адъювантной терапии после хирургического лечения. Препарат под названием сунитиниб помогает предотвратить рецидив.
Таргетные препараты при раке почки назначают, как правило, в режиме монотерапии. Одни из них нужно принимать в таблетках, другие вводят внутривенно. Если препарат не работает, его отменяют и назначают другой.
Таргетная терапия при злокачественных опухолях почек пока изучена недостаточно, нельзя сказать, какое лекарство будет работать лучше всего в данном случае, стоит ли их комбинировать, чтобы усилить эффект, и если стоит, то как это правильно делать. Эти нюансы еще предстоит выяснить в ходе исследований.
Фармакокинетические свойства
Согласно инструкции по применению, ингибитор тирозинкиназы быстро абсорбируется при приеме таблеток внутрь. Предельные уровни концентрации активных веществ достигаются в течение 4-4.5 часов. Биодоступность при приеме препарата добровольцами достигала 59% и повышалась в среднем на 2-3% в случае параллельного приема пищи.
Более 95% действующих веществ связываются с белковыми структурами в плазме крови, преимущественно с альбумином и гликопротеином. Незадействованная фракция в максимуме достигает всего 4-5%.
Тарцева расщепляется под влиянием изоферментов CYP3 A4, которые относятся к аппарату цитохрома Р450. Часть антибластомного средства метаболизируется в тонком кишечнике, тканях раковых новообразований и легких. Производные возникают в процессе О-деметилирования действующих веществ. Такие продукты распада обладают выраженной фармакотерапевтической активностью.
Как это происходит
На поверхности эндотелиальных клеток (клетки, которые выстилают кровеносный сосуд изнутри) образуются рецепторы к ФР. В норме в клетках взрослого организма их нет. Возникают они только при определенных условиях, в нашем случае под действием опухоли. Как только ФР свяжется с рецептором, запускается каскад биохимических реакций, и начинают синтезироваться особые ферменты — металлопротеазы. Они расщепляют внеклеточное вещество, которое окружает эндотелиальные клетки и образует в нем «дырки». Через них эндотелиальные клетки выходят за пределы сосуда и мигрируют к опухоли. При этом, металлопротеазы как бы расчищают для них дорогу, облегчая миграцию. Когда формирование сосуда закончится, в дело вступают факторы, угнетающие ангиогенез — ингибиторы ангиогенеза.
Весь процесс образования капилляра можно представить следующим образом:
- Разрушение стенки кровеносного сосуда под действием металлопротеаз, синтезируемых опухолью.
- Выход эндотелиальных клеток из сосудов и их миграция по направлению к опухоли.
- Пролиферация (размножение) эндотелиальных клеток по мере продвижения в строме.
- Образование новых капиллярных трубок.
- Образование анастамозов между трубками и формирование новой капиллярной сети.
- Угнетение процесса ангиогенеза под действием антиангиогенных факторов.
Факторы, стимулирующие ангиогенез
Пока нет единой классификации факторов, которые стимулируют ангиогенез. Мы их разделим на биомеханические и физические.
Биомеханические факторы
Из биомеханических факторов наибольшее значение имеет ток крови. Постоянный ламинарный (ровный) поток крови способствует стабилизации кровеносных сосудов. И наоборот, турбулентности, циклические деформации и другие сбои приводят к активации эндотелия.
Химические факторы
- Главным стимулятором роста кровеносных сосудов является семейство факторов роста кровеносных сосудов VEGF. Они представлены несколькими видами:
- VEGF А — отвечает за миграцию и деление эндотелиальных клеток,
- VEGF B — обеспечивает эмбриональный ангиогенез. У взрослых людей его максимальная концентрация обнаруживается в сетчатке, ткани головного и спинного мозга и миокарде. Оказывает мощное нейропротекторное действие, поэтому на него возлагают большие надежды в лечении болезни Альцгеймера и инсультов. На проницаемость кровеносных сосудов и их пролиферацию он не влияет.
- VEGF С — в максимальной концентрации обнаруживается в клетках лимфатических сосудов, обеспечивает их рост. В онкологическом процессе играет роль маркера метастазирования.
- VEGF D — отвечает за развитие лимфатических сосудов в легких.
- PLGF — плацентарный фактор роста.
- FGF2 фактор роста фибробластов — при взаимодействии с рецепторами FGFR стимулирует деление эндотелиальных клеток и их миграцию.
- IGF-1 инсулиноподобный фактор роста — стимулирует рост сосудов за счет активации синтеза IL-8.
- Ангиопоэтины — способствуют выживанию мигрировавших эндотелиоцитов, формированию между ними связей, их взаимодействию с перицитами. Таким образом, стабилизируются вновь образованные сосуды.
- Тромбоцитарный фактор роста также отвечает за стабилизацию сосудов.
Какие препараты применяют?
При раке почки применяют таргетные препараты, которые обладают разными механизмами действия, могут блокировать разные вещества.
Сунитиниб
Механизм действия. Данный препарат блокирует образование новых сосудов (ангиогенез), которые опухоль «выращивает», чтобы обеспечить себя кислородом и питательными веществами. Также он ингибирует белки-тирозинкиназы, которые помогают раковым клеткам расти и выживать. Принимают в виде таблеток.
Побочные эффекты:
- Жидкий стул.
- Тошнота.
- Изменение цвета кожи и волос.
- Снижение уровня лейкоцитов и эритроцитов в крови (как следствие, анемия, снижение иммунитета и повышенный риск инфекции).
- Повышение артериального давления.
- Повышенная утомляемость.
- Снижение уровня гормонов щитовидной железы.
- Повышенная кровоточивость.
- Сердечная недостаточность.
Сорафениб
Механизм действия. Так же, как и сунитиниб, блокирует тирозинкиназы и рост новых сосудов. Препарат выпускается в таблетках, принимать при раке почки его нужно два раза в день.
Побочные эффекты:
- Повышенная утомляемость.
- Сыпь на коже.
- Повышенное артериальное давление.
- Жидкий стул.
- Отечность, боль, покраснение и пузыри на ладонях и подошвах (синдром «руки-стопы»).
Эверолимус
Механизм действия. Эверолимус блокирует белок mTOR, который активирует размножение раковых клеток. Обычно его используют в качестве препарата второй линии при запущенном раке почек, если пациенту не помог сорафениб и сунитиниб. Эверолимус принимают в виде таблеток один раз в день.
Побочные эффекты:
- Снижение иммунитета и повышенный риск инфекций.
- Язвы во рту.
- Сыпь на коже.
- Жидкий стул.
- Снижение аппетита.
- Тошнота.
- Отеки на ногах.
- Повышенная утомляемость.
- Повышение уровня холестерина и сахара в крови.
- Редкий серьезный побочный эффект — поражение легких, которое проявляется в виде одышки и других симптомов.
Темсиролимус
Механизм действия. Так же, как эверолимус, блокирует белок mTOR. Этот препарат часто применяют у пациентов с запущенным прогрессирующим раком почки, у которых плохой прогноз ввиду тех или иных факторов. Темсиролимус назначают в виде внутривенных инъекций, вводят один раз в неделю.
Побочные эффекты во многом напоминают таковые у эверолимуса:
- Язвы во рту.
- Повышенная утомляемость, слабость.
- Сыпь на коже.
- Отеки на лице и на ногах.
- Снижение аппетита.
- Тошнота.
- Повышение уровня холестерина и сахара в крови.
Пазопаниб
Механизм действия. Препарат блокирует рост новых кровеносных сосудов в опухоли и белки-тирозинкиназы. Принимают в таблетках, один раз в сутки.
Побочные эффекты:
- Жидкий стул.
- Тошнота.
- Повышенное артериальное давление.
- Головные боли.
- Нарушение работы печени.
- Уменьшение количества лейкоцитов в крови и снижение иммунитета.
- Повышенная кровоточивость, ухудшение заживления ран.
- Аритмии сердца.
Во время лечения пазопанибом нужно контролировать ЭКГ и функции печени (биохимический анализ крови).
Бевацизумаб
Механизм действия. Препарат блокирует рост новых кровеносных сосудов. Эффективность повышается в сочетании с интерфероном-альфа (иммунопрепарат). Вводят бевацизумаб внутривенно.
Побочные эффекты:
- Повышенное артериальное давление.
- Головные боли.
- Слабость, повышенная утомляемость.
- Редко возникают нарушения работы сердца, повышенная кровоточивость, повреждение стенки кишечника.
Акситиниб
Механизм действия. Блокирует ферменты-тирозинкиназы и рост новых кровеносных сосудов. Обычно его применяют как препарат второй линии, если до этого не помогли другие лекарства. Принимается в виде таблеток два раза в день.
Побочные эффекты:
- Тошнота и рвота.
- Слабость, повышенная утомляемость.
- Повышение артериального давления.
- Ухудшение свертываемости крови.
- Иногда нарушается функция печени.
- Ухудшение функции щитовидной железы (необходим контроль во время лечения).
Ленватиниб
Механизм действия. Блокирует тирозинкиназы, рост сосудов, некоторые белки, которые активируют рост злокачественных опухолей. Обычно применяется в сочетании с эверолимусом в качестве препарата второй линии, если другие лекарства не помогли. Ленватиниб принимают в капсулах один раз в сутки.
Побочные эффекты:
- Боль в мышцах и суставах.
- Повышенная утомляемость.
- Жидкий стул (в редких случаях возникает тяжелая диарея).
- Тошнота и рвота.
- Снижение аппетита.
- Повышенное артериальное давление.
- Потеря веса.
- Редко встречаются тяжелые осложнения: нарушение работы сердца, печени, почек, сильное повышение артериального давления, кровотечения, образование тромбов, повреждение стенки кишки.
Почему на некоторые виды таргетной терапии цены очень высокие?
Существенную часть стоимости лечения составляет цена самого препарата. С появлением таргетной терапии в лечении онкологических заболеваний появились новые возможности. В отличие от классических химиопрепаратов, эти лекарственные средства не уничтожают все подряд быстро размножающиеся клетки, а действуют более прицельно.
У каждого таргетного препарата есть определенная молекула-мишень – вещество, за счет которого раковые клетки быстро размножаются, обеспечивают свое выживание и избегают агрессии со стороны противоопухолевого иммунитета.
В настоящее время мировой рынок противоопухолевых препаратов стремительно растет. Например, в 2016 году на завершающих стадиях испытаний находилось около 600 различных молекул. Девять из десяти представляли собой потенциальные таргетные препараты. Это, конечно же, хорошо, ведь появление новых лекарств дает надежду пациентам, страдающим онкологическими заболеваниями на поздних стадиях. Но есть и ложка дегтя: цены на таргетную терапию быстро растут.
Вывод на рынок нового лекарства – сложный и долгий процесс. В среднем для этого нужен миллиард долларов и десять лет упорной работы. При этом молекула, которая кажется перспективной, не обязательно попадет на полки аптек: она может быть «отбракована» на любом этапе испытаний. А все ранее вложенные средства будут потеряны.
Фармпроизводители постоянно инвестируют огромные суммы в разработки, и эти вложения нужно как-то отбивать. Поэтому стоимость каждого нового поколения таргетных препаратов выше.
Немного статистики
В 2012 году на лечение онкологических заболеваний во всем мире было потрачено около 91 миллиарда долларов. К 2016 году эта цифра выросла до 113 миллиардов. Дальше будет больше: эксперты утверждают, что в 2020 году придется потратить уже 173 миллиарда.
Если на лечение одного онкологического больного противоопухолевыми препаратами в 2000 году в США уходило в среднем 10 тысяч долларов, то в 2015 году – 120 тысяч долларов.
При этом в 2011 году в Америке 63% всех затрат на противоопухолевую терапию приходилось на таргетные препараты.
Производителям дженериков несколько проще. Им не нужно тратиться на разработку препарата, клинические исследования. Поэтому такие лекарства стоят дешевле. Но нередко возникают вопросы к качеству. Оно не всегда соответствует уровню оригинальных препаратов. В онкологии это критично.