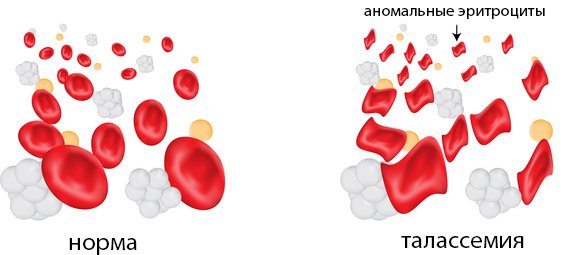
Анемия (малокровие)
Содержание:
Диагноз
Диагноз устанавливают на основании клин, данных, характерной картины крови и результатов исследования костномозгового пунктата.
Дифференциальный диагноз П. а. с другими мегалобластными, в частности фолиево-дефицитными, анемиями проводят на основе теста Шиллинга, заключающегося в том, что у больного П. а. введенный внутрь радиоактивный витамин B12 и одновременно парентерально не радиоактивный витамин B12 (1000 мкг) определяются в моче лишь в минимальных количествах, что указывает на нарушенную абсорбцию витамина B12, которая связана либо с нарушением секреции внутреннего желудочного фактора, либо с нарушением кишечного всасывания витамина B12; в последнем случае прием концентрата внутреннего желудочного фактора не улучшает абсорбцию витамина B12. П. а. дифференцируют с симптоматическими мегалобластными (пернициозноподобными) анемиями, возникающими при опухолях желудка, дивертикулах и опухолях тонкой и слепой кишок, а также с агастральной, анентеральной и глистной B12-дефицитной анемиями (см. Анемия), при которых мегалобластная анемия развивается в результате нарушения секреции внутреннего желудочного фактора или абсорбции витамина B12 в кишечнике. П. а. дифференцируют также с системными заболеваниями, напр, эритромиелозом (см. Лейкозы), для которого характерны мегалобластоз костного мозга при повышенном содержании витамина B12 в крови (до 1000 нг/мл и выше) и отсутствие терапевтического эффекта от введения витамина B12 (так наз. B12-ахрестическая анемия).
Патологическая анатомия
Смертельные случаи в связи с успешным лечением П. а. встречаются крайне редко. При вскрытии умерших в остром периоде болезни выявляется общее малокровие, желтушность кожи, серозных и слизистых оболочек, жировая дистрофия миокарда, печени, почек. Кровь в сердце и крупных сосудах жидкая, водянистая. Вследствие выраженной гиперплазии кроветворных элементов и исчезновения жира костный мозг плоских костей, а также диафизов и эпифизов трубчатых костей очень сочный, малиново-красного цвета. Характерны атрофические изменения в жел.-киш. тракте.
Сосочки языка, особенно в области корня, атрофичны, сглажены. Слизистая оболочка языка содержит красноватые участки воспаления, располагающиеся чаще по краям и на кончике, иногда афтозные высыпания, трещины (картина так наз. гунтеровского глоссита). Сходные изменения могут наблюдаться в слизистой оболочке десен, щек, мягкого неба, глотки, пищевода. Постоянно выявляется атрофия слизистой оболочки желудка, наиболее выраженная в области дна; складки слизистой оболочки сглажены или не определяются, стенка желудка истончена, в некоторых случаях имеются полипозные разрастания. Атрофические изменения могут наблюдаться также в слизистой оболочке кишечника. Размеры селезенки — в пределах или несколько больше нормы. Печень увеличена незначительно, плотновата. Вследствие отложения гемосидерина ткань селезенки, печени, иногда почек на разрезе имеет ржавый оттенок. Лимф, узлы небольшие, мягкие. В некоторых: случаях макроскопически в спинном мозге выявляются мелкие очаги некроза с размягчением. Иногда находят мелкоточечные кровоизлияния в. серозных и слизистых оболочках, в коже.
Микропрепарат слизистой оболочки желудка при пернициозной анемии: 1 — атрофия желез, 2 — инфильтрация и склероз собственной пластинки слизистой оболочки; окраска гематоксилин-эозином; X 70.
Микроскопически в красном костном мозге отмечается выраженная гиперплазия клеток эритроидного ряда с наличием среди них большого количества мегалобластов — крупных клеток, имеющих нежноячеистую структуру ядра с отчетливо видимыми ядрышками и широкую зону базофильной или полихроматофильной цитоплазмы. Число клеток лейкоцитопоэза несколько снижено. Мегакариоциты содержатся в достаточном или уменьшенном количестве. Наблюдаются выраженные дистрофические изменения и распад клеток, особенно эритроидного ряда, обилие эритро-и сидерофагов. В слизистой оболочке желудка выявляется картина атрофического гастрита, имеется значительное уменьшение количества желез и железистых клеток, особенно обкладочных. Клетки уменьшены в размерах, пикнотичны, уплощены, вследствие чего просвет желез расширен. Возрастает количество слизеобразующих железистых клеток, встречаются участки кишечной метаплазии поверхностного эпителия. Строма слизистой оболочки склерозирована, инфильтрирована лимфоцитами, плазматическими клетками, единичными сегментоядерными нейтрофильными гранулоцитами (рис.). Изменения наиболее выражены в дне желудка, однако интенсивность их может варьировать в различных участках слизистой оболочки. Атрофические изменения не подвергаются обратному развитию при лечении витамином B12 и сохраняются в период ремиссии заболевания.
При биопсии слизистой оболочки тонкой кишки выявляются укорочение кишечных ворсинок, дистрофические изменения железистых клеток со снижением в них фигур митозов в криптах, лимфоидно-плазмоцитарная инфильтрация стромы. После лечения витамином B12 эти изменения могут исчезнуть. Наряду с атрофическими изменениями наблюдается дистрофия нервных волокон языка, нервных клеток подслизистого сплетения (plexus submucosus, s. Meissneri) и мышечно-кишечного сплетения (plexus myen-tericus, s. Auerbachi).
Характерны дистрофические изменения в задних и боковых столбах спинного мозга, преимущественно в шейном отделе, выражающиеся в очаговом набухании с последующим распадом миелиновых нервных волокон. Слияние мелких очагов приводит к образованию больших участков поражения. В некоторых случаях наблюдаются дистрофические изменения черепно-мозговых (черепных, Т.) и периферических нервов. Имеет место гемосидероз костного мозга, селезенки, печени, лимф, узлов, почек, выраженный в различной степени. В селезенке, лимфатических узлах нередко встречаются очаги экстрамедуллярного кроветворения.
Лечение
Лечение должно быть направлено на устранение причин анемии (прекращение и предупреждение кровопотере при необходимости — оперативное удаление их источника; лечение заболеваний желудка и кишечника и т. д.) и на ликвидацию дефицита железа (железо-терапия).
Для пероральной железотерапии применяется ряд препаратов. Наиболее эффективны и хорошо переносимы гемостимулин, ферроцерон и комплексные препараты сернокислого железа.
Аскорбиновая к-та, назначаемая одновременно с препаратами железа или входящая в их состав, обеспечивает лучшее усвоение железа. Полезны одновременные инъекции витамина B6 и прием фолиевой к-ты. Если наблюдается отставание роста числа эритроцитов, то может быть рекомендовано введение витамина В12 в конце курса железотерапии.
Парентеральная железотерапии показана при непереносимости приема препаратов железа внутрь, их неэффективности, агастрии, при противопоказаниях к пероральной терапии (язвенные и воспалительные процессы в жел.-киш. тракте), тяжелой анемии, требующей быстрого купирования (в предоперационном или предродовом периоде). Для внутримышечного введения рекомендуются фербитол или ектофер; для внутривенного введения — ферковен или феррум Лек. В ампулах этих препаратов содержится по 100 мг железа. Число инъекций рассчитывается по формуле, данной в специальной инструкции (обычно от 15 до 30 инъекций).
Критерием эффективности железотерапии является увеличение гемоглобина (на 0,15—0,3 г% в сутки. Продолжительность курса лечения зависит от нормализации сывороточного железа, а в клин, условиях исследуется депо железа по десфераловой пробе.
Гемотерапия при Ж. а. применяется при глубокой анемии и необходимости быстрого купирования анемической гипоксии, а также при гипорегенераторных формах, резистентных к железотерапии. Предпочтительны переливания эритроцитной массы по 125—150 мл 2 раза в неделю в количестве 3—4 трансфузий. Рекомендуется полноценное питание.
Этиология и патогенез
Железодефицитные анемии могут быть обусловлены рядом причин. Повторные кровопотери, даже необильные и скрытые, ведут к потере железа, истощению его резервов в организме и развитию латентного дефицита железа, а затем хронической постгеморрагической Железодефицитной анемии. Причиной кровопотерь часто являются маточные кровотечения, реже жел.-киш., почечные, легочные и др.
Железодефицитная анемия может развиваться под влиянием экзогенных факторов. Так, анемия, связанная с недостатком железа в пище, отмечается у детей, находящихся на однообразном молочном питании, особенно при искусственном вскармливании коровьим или козьим молоком. Для развития Ж. а. у новорожденных может иметь значение дефицит железа у матери во время беременности. В СССР и других экономически развитых странах алиментарная Ж. а. у взрослых встречается редко — при длительной однообразной, преимущественно молочной диете. В развивающихся странах среди необеспеченных слоев населения алиментарная недостаточность может быть причиной анемий гораздо чаще. Другие экзогенные факторы (инфекции, интоксикации, глистные инвазии) влияют на эндогенные механизмы обмена и утилизации железа, что приводит к его перераспределению и развитию относительного дефицита.
Эндогенная недостаточность железа может быть следствием повышенного расхода железа в периоды роста и созревания организма, а также беременности, лактации. Причиной Ж. а. у девушек в пубертатном периоде (ранний, или ювенильный, хлороз) может явиться повышение потребности организма в железе в связи с ростом, появлением менструальных кровотечений, угнетающим действием эстрогенных гормонов на синтез гема. Ж. а. у взрослых женщин обычно связана с маточными кровотечениями (дисфункциональными или на почве фибромиомы матки). Нарушение абсорбции железа и других веществ, важных для кроветворения, происходит также после резекции желудка или части тонкой кишки.
Железодефицитная анемия может быть обусловлена как каждым из перечисленных факторов в отдельности, так и одновременным сочетанием всех или ряда из них. Возможно развитие Ж. а. на фоне хрон, воспалительного процесса, бластоматозов (ранее они объединялись понятием «симптоматические хлоранемии»). В этих случаях, помимо дефицита железа, который носит перераспределительный характер, имеет место миелотоксическое действие основного процесса на гемопоэз.
Патогенез Ж. а. заключается в нарушении синтеза гема из-за недостатка железа в организме и развитии истинного дефицита железа (с истощением его резервов) или в нехватке железа для эритропоэза вследствие перераспределения.
Гейнрих (Н. С. Heinrich, 1970) различает следующие стадии развития дефицита железа: 1) прелатентный дефицит железа, определяемый гистохимически по отсутствию гемосидерина в макрофагах ретикулогистиоцитарной системы костного мозга, а косвенно — на основании повышенной кишечной абсорбции железа; 2) латентный дефицит железа, характеризующийся снижением концентрации сывороточного железа и повышением общей и особенно латентной железосвязывающей способности сыворотки (ОЖСС и ЛЖСС); 3) железодефицитная (гипосидеремическая) анемия с дальнейшим снижением содержания железа в организме и нарушением гемоглобинизации эритроцитов.
Современные представления о патогенезе дефицита железа и развитии Ж. а. опираются на исследования обмена железа в нормальных и патол, условиях. Потеря железа при повторных кровотечениях или недостаточность его всасывания в связи с уменьшением поступления с пищей, а также нарушением абсорбции ведет к уменьшению резервов железа, снижению сывороточного железа и повышению ОЖСС и особенно ЛЖСС с уменьшением процента насыщения переносчика железа— трансферрина (сидерофилина). В результате снижается транспорт железа в костный мозг и уменьшается его включение в клетки эритропоэтического ряда путем микропиноцитоза из ретикулярных клеток или прямой передачи от трансферрина через рецепторные участки ретикулоцитов. При этом снижается поступление в клетку железа, необходимого для синтеза гема.
Следствием нехватки железа для синтеза гема является увеличение протопорфирина в эритроцитах при некоторых формах Ж. а. В условиях дефицита железа резервы его мобилизуются для нужд эритропоэза, что ведет к уменьшению, в частности, костномозгового депо железа. Нарушение образования гема и гемоглобинизации эритробластов является конечной фазой недостаточности эритропоэза, вызванной истинным или перераспределительным дефицитом железа в организме.
Диагностика
Что такое микроцитоз, знает врач-гематолог. Этот специалист может установить причины возникновения отклонений со стороны эритроцитов. Основной диагностической процедурой выступает общий анализ крови.
Несмотря на это, для выявления патологического или физиологического фактора необходим комплексный подход, поэтому процесс диагностирования включает не только лабораторные тесты и инструментальные процедуры, но и такие мероприятия:
- изучение истории болезни как пациента, так и его близких — возможность установить основной источник с патологической основой;
- сбор и анализ жизненного анамнеза — для выявления физиологических предрасполагающих факторов;
- оценка состояния кожи, слизистых оболочек, волос и ногтевых пластин;
- измерение частоты сердечного ритма;
- детальный опрос — для получения клиницистом полной картины протекания микроцитоза.
Среди дополнительных лабораторных исследований выделяют такие тесты:
- биохимия крови;
- гормональные пробы;
- печеночные тесты;
- бактериальный посев крови.
Общие инструментальные процедуры:
- ФГДС;
- УЗИ щитовидной железы;
- рентгенография органов брюшины;
- КТ и МРТ внутренних органов.
Этиология и патогенез
Ведущим фактором в этиологии П. а. является эндогенная недостаточность витамина B12, возникающая вследствие нарушения его всасывания в результате снижения или полного прекращения секреции внутреннего желудочного фактора (гастромукопротеина), необходимого для связывания и последующей абсорбции витамина B12. П. а. может возникнуть в результате поражения жел.-киш. тракта, напр, воспалительным или злокачественным процессом, а также после субтотального или тотального удаления желудка и после обширной резекции части тонкого кишечника. В редких случаях П. а. развивается при нормальной секреции внутреннего желудочного фактора и обусловлена врожденным отсутствием транскобаламина II (белка плазмы крови), с которым витамин B12 связывается и доставляется в печень и красный костный мозг, или отсутствием в кишечнике белкового акцептора витамина B12, необходимого для поступления витамина B12 из кишечника в кровеносное русло. На роль генетического фактора указывают случаи семейных заболеваний, а также возникновение П. а. на почве врожденного нарушения секреции внутреннего желудочного фактора, наследуемого по аутосомно-рецессивному типу. Об участии иммунных механизмов при П. а. свидетельствует наличие в сыворотке крови у большинства больных П. а. и их родственников антител, направленных против париетальных гландулоцитов желудка, а также антител (IgG) против внутреннего желудочного фактора, к-рые определяются как в париетальных гландулоцитах (при гастробиопсии), так и в цитоплазме плазматических клеток красного костного мозга авторадиографией (см.). О существовании аутоиммунных процессов говорят случаи сочетания П. а. с тиреоидитом Хасимото (см. Хасимото болезнь), при этом одновременно присутствуют антитиреоидные антитела и антитела к париетальным гландулоцитам желудка. Аутоиммунный генез П. а. подтверждает успешное применение кортикостероидов. В ряде случаев П. а. возникает без участия специфических антител.
Нарушение кроветворения (см.) характеризуется мегалобластозом красного костного мозга с поражением всех трех ростков кроветворения — эритроидного, гранулоцитарного и мегакариоцитарного. Особенностью мегалобластического эритроцитопоэза является его неэффективность, обусловленная резким нарушением процессов дифференциации эритроидных клеток, в результате которого в красном костном мозге происходит накопление аномальных эритроидных клеток — промегалобластов и мегалобластов. Мегалобластический эритроцитопоэз обусловлен резким снижением активности В ^-зависимых энзимов, участвующих в метаболизме фолатов (солей фолиевой к-ты), необходимых для синтеза ДНК; в частности, снижение активности метилтрансферазы сопровождается кумуляцией в клетках неактивного метилтетрагидрофолата и снижением синтеза ДНК, что приводит к нарушению клеточного деления и развитию мегалобластоза.
Повышенная «интрамедуллярная смертность» мегалобластов, выявляемая при биопсии костного мозга в виде интенсивного эритрофагоцитоза и гемосидероза (см.), ведет к резкому снижению продукции эритроцитов, т. е. к анемии. В то же время в результате повышенного распада гемоглобинизированных мегалобластов (полихроматофильных и оксифильных) возникают симптомы гемолитической анемии (см.) — не-конъюгированная гипербилирубинемия, плейохромия (увеличенное содержание пигментов) желчи, уробилинурия, повышенное выделение стеркобилина с калом. Не исключена возможность участия антител в костномозговом разрушении эрит-рокариоцитов.
Диагноз
Диагноз ставят на основании описанных симптомов и результатов специальных исследований. 1. Определение сывороточного железа, ОЖСС и ЛЖСС с вычислением процента насыщения трансферрина; повышение ОЖСС и особенно ЛЖСС со снижением сывороточного железа и процента насыщения трансферрина свидетельствует о железодефицитном характере анемии или наличии латентного дефицита железа без анемии; атрансферринемия или сочетание протеинопривного и железодефицитного генеза анемии могут вести к снижению ОЖСС наряду с гипосидеремией. 2. Определение резервов железа путем введения в организм комплексона десферала (десферриоксамина), который, соединяясь с негемоглобиновым железом тканей, выводит его из депо в кровяное русло и выделяется с мочой: уменьшение мочевой экскреции железа при десфераловой пробе говорит об истощении резервов железа в организме при Ж. а., обнаруживает их снижение при латентном дефиците железа, позволяет контролировать пополнение резервов при железотерапии; десфераловая проба дифференцирует истинный и перераспределительный дефицит железа — при последнем мочевая экскреция железа бывает повышена, несмотря на гипосидеремию (блокирование железа в ретикулогистиоцитарной системе). 3. Определение костномозговых резервов железа (сидеробластов и сидероцитов): внутриклеточное негемоглобиновое железо костного мозга можно исследовать с помощью не только световой, но и электронной микроскопии, позволяющей проследить процесс включения железа в эритроидные клетки путем микропиноцитоза и установить переход его гранул в митохондрии. 4. Изучение порфиринового обмена (см. Порфирины), который связан с обменом железа в синтезе гема: при истинной Ж. а. часто отмечается увеличение порфиринов, особенно свободных протопорфиринов, в эритроцитах; при инфекционных анемиях вследствие нарушения порфиринового обмена преобладает увеличение копропорфирина и снижение протопорфирина.
Железодефицитную анемию следует дифференцировать с железорефрактерной анемией (см.), протекающей с гипохромией эритроцитов. Для уточнения характера нарушения обмена железа определяют уровень транспортного железа сыворотки, проводят десфераловую пробу, подсчитывают количество сидероцитов и сидеробластов костного мозга.
Профилактика
Профилактика рецидивов Железодефицитной анемии — повторные курсы железо-терапии в течение 1 — 1,5 мес. 2 раза в год или чаще. При установленном латентном дефиците железа среди обследованной группы населения или наличии предпосылок к его развитию (доноры, длительно дающие кровь, женщины с меноррагиями, агастрия или органическая ахлоргидрия) рекомендуются длительнопрерывистые профилактические курсы железотерапии (1 четырехнедельный и 3 двухнедельных курса в год).
Рекомендуется пища, богатая белками, витаминами, железом и другими микроэлементами (фрукты). Полезно пребывание в горах; противопоказана длительная инсоляция.
Гипопластическая анемия, причины, диагностика, лечение
панцитопениейСимптомы гипопластических анемий
- Кровотечения, кровоточивость десен, ломкость сосудов, синяки на коже и т.д. Данные явления возникают вследствие низкого содержания тромбоцитов в крови.
- Язвенно – некротические поражения рта, глотки, носа, кожи. Присоединение инфекций. Это происходит из-за малого количества лейкоцитов в крови.
- Головокружения, головные боли, шум в ушах, сонливость, утомляемость, обмороки, нарушения сна, одышка, учащение сердцебиения и т.д.
- В общем анализе крови уменьшение содержания всех клеток крови – эритроцитов, лейкоцитов, тромбоцитов. В костном мозгу картина запустения, так как очаги кроветворения заменяются жировой тканью.
Причины, вызывающие развитие гипопластической анемии
| Внешние факторы | Внутренние факторы |
| Физические – радиация, высокочастотные токи, вибрация | Генетические – мутации, вследствие неизвестных причин |
| Механические – травмы | Эндокринные – заболевания щитовидной железы, сахарный диабет, заболевания яичников, при которых их функция усилена |
| Химические – промышленные яды, некоторые лекарства | Системные заболевания соединительной ткани – системная красная волчанка, ревматоидный артрит |
| Биологические – вирусы, в основном группы герпес, грибки, внутриклеточные бактерии | Нарушение питания – недостаток веществ, нужных для кроветворения |
Принципы лечения гипопластических анемий
Лейкоциты
- Эозинофилы – белые клетки крови, которые формируются в костном мозге. Причиной повышения эозинофилов в организме человека могут стать аллергические, инфекционные и паразитарные заболевания, такие как астма, аскаридоз и пр. Низкое количество эозинофилов может говорить о присутствии гнойных процессов в организме, заболеваний, связанных со щитовидной и поджелудочной железой, тяжелых инфекций.
- Базофилы – это гранулоциты крови, которые поддерживают кровоток в небольших сосудах и участвуют в возникновении аллергических реакций. Повышение базофилов наблюдается, если человек контактировал с аллергеном, при хронических воспалениях и заболеваниях желудочно-кишечного тракта, а также в предменструальный период.
- Моноциты – белые кровяные клетки, которые с помощью превращения в макрофаги контролируют инфекции, поглощая бактерии. Повышение моноцитов говорит о присутствии в организме заболевания вирусной или бактериальной природы, таких как туберкулез, сифилис, воспаление тонкого кишечника, артрит и пр. Причины понижения моноцитов могут свидетельствовать о том, что человек голодал, подвергался изнуряющим физическим нагрузкам, перенес стресс или хирургическое вмешательство.
- Лимфоциты – клетки, участвующие в формировании иммунной реакции. Их основная задача состоит в том, чтобы распознать возбудителя болезни. Если при расшифровке анализа крови зарегистрирован повышенный уровень лимфоцитов, то это свидетельствует о наличии вирусных или бактериальных инфекций (сифилис, коклюш, туберкулез). Увеличение печени, лимфатических узлов, рвота, тошнота, повышенная температура – все это причины для повышения уровня лимфоцитов. Пониженный уровень лимфоцитов может свидетельствовать о длительной инфекции, ВИЧ, заболеваниях кожи, истощении иммунной системы. При расшифровке анализа крови у женщин, это может свидетельствовать о беременности. Чтобы выявить истинную причину снижения уровня лимфоцитов, нужна консультация специалиста.
- Нейтрофилы – это тип лейкоцитов, основная задача которых заключается в борьбе с инфекциями бактериальной природы. При пониженном уровне нейтрофилов говорят о нейтропении, которая развивается на фоне гепатитов, сепсиса, вирусных инфекций, при приеме антибиотиков. При обнаружении в расшифровке анализа крови низкого уровня нейтрофилов рекомендуется проконсультироваться с врачом для восстановления нормальных показателей.