Липидный обмен
Содержание:
- Обмен жиров
- Долихолы
- Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
- Реабилитация Жира! Классификация пищевых жиров и в каких продуктах они есть
- Нарушение жирового обмена: ожирение
- Практические рекомендации
- Увеличение работоспособности в отдельном занятии
- Всасывание липидов
- Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
- Ресинтез липидов в энтероцитах
- Образование мицелл
- Гистохимические методы определения в тканях
- Биосинтез триглицеридов
- Общий принцип биосинтеза липидов
Обмен жиров
К жирам относят неоднородные в химическом отношении вещества, которые делят на простые липиды (нейтральные жиры, воски), сложные липиды (фосфолипиды, гликолипиды, сульфолипиды) и стероиды (холестерин и др.). Основная масса липидов представлена в организме человека нейтральными жирами. Нейтральные жиры пищи человека являются важным источником энергии. При окислении 1 г жира выделяется 38,3 кДж (9,3 ккал) энергии. За счет окисления нейтральных жиров образуется около 50% энергии взрослого человека и около 40% энергии грудного ребенка. Нейтральные жиры являются источником эндогенной воды (при окислении 100 г жира освобождается 107-Ю-3 л воды). Они способствуют нормальному обмену воды в организме. Нейтральный жир является обязательной составной частью протоплазмы, ядра и оболочки клетки, выполняя тем самым пластическую функцию. Жир может депонироваться в виде жировых капель, преимущественно в подкожной жировой клетчатке. В этом случае жир предохраняет организм от усиленной отдачи тепла. Если жир отложился в других местах, то он защищает органы от травматических повреждений.
Суточная потребность взрослого человека в нейтральном жире составляет 70-80 г, детей 3-10 лет- 26-30 г.
Нейтральные жиры в энергетическом отношении могут быть заменены углеводами. Однако есть ненасыщенные жирные кислоты — линолевая, линоленовая и арахидоновая, которые должны обязательно содержаться в пищевом рационе человека, их называют незаменимыми жирными кислотами. Длительное отсутствие незаменимых жирных кислот в пище приводит к замедлению роста у молодых животных и потере способности к размножению у взрослых. Суточная потребность в этих кислотах для человека составляет 10-12 г.
Линоленовая и линолевая кислоты в значительном количестве содержатся в растительных жирах, в меньших количествах — в животных жирах. Арахидоновую кислоту обнаруживают только в животных жирах.
Нейтральные жиры, входящие в состав пищи и тканей человека, представлены главным образом триглицеридами, содержащими жирные кислоты — пальмитиновую, стеариновую, олеиновую, линолевую и линоленовую.
В нормальных условиях количество жира в организме составляет 10-20% массы тела. При употреблении пищи, содержащей небольшие количества жира, в теле животных и человека откладывается жир, свойственный видовым особенностям данного организма. Если же в питании длительно используют большие количества какого-либо одного вида жира, состав жировых депо меняется.
В межуточном обмене жиров важная роль принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (β-оксимасляная и ацетоуксусная кислоты, ацетон). Кетоновые тела используются как источник энергии.
Фосфо- и гликолипиды входят в состав всех клеток, но главным образом в состав клеток нервной системы. Фосфолипиды синтезируются в кишечной стенке и в печени. Однако только клетки печени способны выделять фосфолипиды в кровь, поэтому печень является практически единственным органом, поддерживающим уровень фосфолипидов в крови. Холестерин и другие стероиды могут поступать с пищей или синтезироваться в организме. Основным местом синтеза холестерина является печень. Неиспользованный холестерин подвергается расщеплению в печени, и продукты его распада превращаются в желчные кислоты. Они поступают в кишечник с желчью. Часть холестерина может проходить непосредственно из крови через стенку толстого кишечника в его полость.
В жировой ткани нейтральный жир депонируется в виде триглицеридов. По мере необходимости происходит мобилизация жира, т. е. распад триглицеридов с освобождением неэстерифицированных (свободных) жирных кислот.
Образование жиров из углеводов. Избыточное употребление в пищу углеводов приводит к отложению жира в организме. В норме у человека 25-30% углеводов пищи превращается в жиры.
Образование жиров из белков. Белки являются пластическим материалом. Организм сберегает эти ценные вещества. Только при чрезвычайных обстоятельствах белки используются для энергетических целей. Превращение белка в жирные кислоты происходит, вероятнее всего, через образование углеводов.
Долихолы
Долихолы являются дериватами ФПФ и изопентил-1-пирофосфата, обычно содержащими 16–22 молекулы изопрена, протяженность единственной цепи которых чрезвычайно варьирует в зависимости от типа клеток у организмов разных видов. Долихолы опосредуют N-терминальное гликозилирование образующихся полипептидов, которые участвуют в транспорте и депонировании олигосахаридного ядра, необходимого для последующей гликации белков. Гликозилирование — это достаточно сложный процесс модификации протеинов, являющийся, однако, интегральным компонентом в реализации биологической функции белков.
Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
Концентрация апо-B-содержащих липопротеидов в плазме крови является результатом метаболического регулирования их продукции, изменения клиренса или конверсии. Наиболее типичные виды метаболического регулирования содержания апо-В представлены на рис. 2.4. В физиологических условиях, ЛПОНП1 являются основными липопротеидами, секретирующимися гепатоцитами. Непосредственно после синтеза ЛПОНП1 конвертируются в ЛПОНП2, а последние — в ЛППП, при этом их концентрация в плазме крови сохраняется достаточно низкой именно за счет высокой скорости конвертации. С другой стороны, ЛПНП значительно медленнее выводятся из циркуляции (период циркуляции составляет 2–4 сут), что приводит к относительному преобладанию этого типа липопротеидов по отношению к другим фракциям. С возрастом продукция апо-В-липопротеина обычно повышается, что ассоциируется со снижением экспрессии рецепторов к ЛПНП (Matthan N.R. et al., 2005). При некоторых состояниях, например, при ожирении, синтез ЛПОНП особенно высок, что способствует увеличению плазменного уровня апо-В и ЛПНП (Chan D.C. et al., 2004). Установлено, что повышение уровня ЛПОНП1 может сопровождаться гиперинсулинемией даже у здоровых лиц (Malmstrom R. et al., 1997). При инсулинорезистентности недостаточная регуляция продукции ЛПОНП негативно отражается на плазменном уровне апо-B-липопротеина, что способствует повышению концентрации ЛПОНП, ЛППП, ЛПНП, формируя проатерогенную гиперлипидемию (Taskinen M.R., 2003).
Рис. 2.4. Метаболическая регуляция уровня апо-B-липопротеина в плазме крови. Модифицирован из работы C.J. Packard и соавт., 2000
У лиц со значительным повышением уровня ХС ЛПНП (>4,5 ммоль/л) в плазме крови выявляют увеличение содержания апo-B-липопротеинов преимущественно за счет редукции клиренса рецепторов к ним. Последние представляют собой регулируемые мембранассоциированные протеины, ответственные за распознавание и интернационализацию липопротеинов, а также активное поступление ХС в клетки (Turley S.D., 2004). Снижение экспрессии рецепторов или различные варианты качественного изменения в структуре их субъединиц являются морфологической основой возникновения ряда наследственных нарушений липидного обмена, таких как семейная гиперхолестеринемия (см. главу 6). Необходимо отметить, что концентрация ЛПНП может подвергаться непосредственному метаболическому регулированию со стороны ЛПОНП2, уровень которых, в свою очередь, зависит от ЛПОНП1 (Gaffney D. et al., 2002).
У пациентов с изолированной гипертриглицеридемией обычно отмечают избыточную продукцию ЛПОНП (особенно ЛПОНП1) на фоне неэффективного липолиза (Chan D.C. et al., 2004). Это приводит к повышению содержания апо-В в плазме крови, поскольку последний является транспортной формой как для ЛПОНП1, так и для ЛПОНП2. Кроме того, у таких больных не только существенно снижен клиренс апо-В-содержащих липопротеидов, но и имеется возможность для их более интенсивной модификации. Так, CETP транспортирует ТГ от ЛПОНП к ЛПНП и ЛПВП, тогда как эстерифицированный ХС перемещается в обратном направлении. При этом апо-C-II, апо-C-III и апо-Е поочередно включаются в состав липопротеидов, заменяя друг друга. Все это приводит к тому, что в длительно циркулирующих в плазме крови молекулах ЛПОНП снижается содержание aпo-C-липопротеина, тогда как удельный вес aпo-E и эстерифицированного ХС возрастает. Подобная модификация ЛПОНП способствует появлению резистентности последних к липазе и обусловливает формирование так называемых ремнантных форм ЛПОНП (Havel R.J., 2000).
Реабилитация Жира! Классификация пищевых жиров и в каких продуктах они есть
28.09.201420:10
Диетологи реабилитировали сливочное масло и другие жиры! В конце июня 2014 года на обложке журнала Time появился аппетитный кусок – сливочного масла, и призыв его есть!Эксперимент с обезжиренными продуктами, который был запущен в 70-е годы 20 века американскими диетологами «не оправдал» ожидания: заболеваемость ожирением и сахарным диабетом с годами только возрастала . Отмечено, что люди активно ограничивающие жиры в рационе начинают больше «злоупотреблять» углеводами (а это злаковые, крупы, также фрукты и овощи с высоким гликемическим индексом, более 50.)При употребление обезжиренных продуктов очень медленно возникает чувство насыщения, что и чревато перееданием углеводов ( ведь «жиры — это главный вред «, как считали раньше) и превышением калорийности рациона. Жир – он же холестерин, важен для организма, как любой другой продукт, но в «умеренной дозе». Из холестерина, если посмотреть биохимическую цепочку, образуются все половые гормоны (а их дефицит в организме грозит многими проблемами, и не только нарушением цикла, даже бесплодием),образуется фосфолипидная защитная «оболочка» клеток, в том числе «фосфолипидное покрытие» кожи, с помощью жиров усваиваются жирорастворимые витамины А 1(ретинол), витамин Е и микроэлемент — кальций, и гормоновитамины – А2 (дегидроретинол), и т.д.Кроме того, гормон стресса – кортизол образуется из холестерина, а с помощью этого гормона наш организм ежедневно «справляется» со стрессом, а при заболевании — и с воспалением, например, при бронхиальной астме.Когда нарушен жировой обмен — это заметно сразу, девушка может быть стройной, но с «большим» животом или бёдрами. В таком распределении, как правило, есть генетическая предрасположенность, фигура почти точно повторяет фигуру одного из родственников, жир откладывается в зонах определяющих конституцию. Вот в таком случае жиры в рационе надо ограничивать, а если сдать кровь, то в липидограмме можно обнаружить признаки начинающегося атеросклероза: повышено количество холестерина, триглицеридов и/или хиломикронов, так активно «забивающих» печень, мышцы, сосуды и т.д. Но «жиры жирам рознь», и не все жиры одинаковые. РазберёмМононенасыщенные жиры: содержатся в оливковом масле, гусином и утином жире, под приставкой «моно» подразумевается, что этим жирам не надо расщепляться на более простую для всасывания форму, они и так «простые». Используются в организме сразу после всасывания, чаще для получения «энергии» . Рекомендуемая доза оливкового масла в сутки – 2 столовые ложки в холодном виде.Полиненасыщенные жиры – рыбий жир, рапсовое и льняное масло, расщепляются медленнее, используются как основной «строительный материал» для клеток, участвуют в антиоксидантных процессах.Насыщенные жиры – сливочное масло, говяжий жир, баранина, свинина, расщепляются долго, чаще используются организмом «про запас». Рекомендуемая суточная доза сливочного масла — 30 грамм.Жир вреден, когда организм не может его вовремя израсходовать: его или много поступило с едой, или он не «уходит» как поставщик энергии – мало физической нагрузки, не хватает ферментов правильно его усваивающих – липазы, или не хватает соляной кислоты, желчи и т.д. У детей до 10 лет «обезжиривать рацион под ноль» совсем не рекомендуется, так как у ребёнка продолжают формироваться нервные структуры мозга, а их миелиновая оболочка состоит из «жиров»), кроме того, запускается пубертат (и нужны половые гормоны)! Детская диета предполагает ограничение легкоусваиваемых углеводов (сладостей, соков, газировок и т.д.)Жиров в рационе должно быть около 30 % общей суточной нормы, 40% белков, остальное – углеводы.Например, в каждом нижеприведённых вариантов меню завтрака, обеда или ужина, содержится суточная норма «жира», выбирайте: Утро— 1 яйцо + 20 гр сыра + 30 гр сливочного маслаОбед – порция риса бурого 100 гр, салат 100 гр с растительным маслом + 200 гр красной рыбы или 200 гр говядины + 150 гр овощи–грильУжин- 150 гр 5 % творога и кусочек зернового хлеба .. сытно и безобидно для здоровья! подготовлено по материалам Allur,10(2014)
Просмотров:4596
Нарушение жирового обмена: ожирение

У женщины жировая ткань составляет 20–25 % от массы тела, у мужчины — 15–20 %. Ожирение — нарушение жирового обмена, при котором вес человека на 20 % больше идеальной отметки для данного индивида.
Среди причин первичного ожирения находятся:
- генетические нарушения жирового обмена (80 %);
- неправильный режим питания (состав и количество пищи);
- недостаток физической активности;
- психологические факторы.
Наследственность определяет особенности жирового обмена. Например, генетически обусловленная разница в функционировании «бесполезных» (субстратных) циклов.
Также в нарушении жирового обмена играет роль ген ожирения (obese gene). Продуктом его экспрессии являет лептин. У 80 % страдающих ожирением его концентрация в четыре раза выше, чем у людей с нормальной массой тела. Изменения в первичной структуре лептина наблюдаются у 20 % больных. Сегодня выявлены пять одиночных мутаций в гене лептина, приводящие к ожирению.
Вторичное ожирение развивается на фоне основного заболевания. Например, при наличии гипотиреоза, синдрома Иценко-Кушинга, гипогонадизма и др.
Практические рекомендации
Применения принципов тайминга нутриентов во время выполнения программ тренировки с отягощениями позволит максимально увеличить адаптационный ответ на тренировочные стимулы. Упорядоченный во времени приём белков/аминокислот и углеводов будет восполнять гликоген мышц, понижать болезненность мышц и уровень деградации белка, индуцировать положительный общий баланс белка и способствовать росту силы и массы мышц большему, чем при выполнении тренировочной программы самой по себе.
В настоящее время нет единого мнения относительно количества белка/аминокислот и углеводов для обеспечения максимального роста мышц. Основываясь на доступной литературе, 1 г/кг/час углеводов (непосредственно после и спустя 1 час) будут эффективно восстанавливать истощённый гликоген мышц и уменьшать деградацию белков. В отношении белка, 20 — 25 г протеина высокого качества с быстрым усвоением, принимаемые aнепосредственно после упражнений с отягощениями, максимально увеличивают синтез белка, снижают болезненность мышц и увеличивают их массу. Если рассматривать относительные величины, то 0,25 г высококачественного, легко усваиваемого белка на килограмм массы тела, скорее всего, обеспечивают адекватное количество незаменимых аминокислот для получения вышеупомянутых преимуществ. Исследования, поддерживающие этих рекомендации, накоплены за последние 10 — 15 лет благодаря учёным, которые внесли свой вклад в развитие науки о своевременном потреблении питательных веществ. В перспективе необходимо изучить влияние тайминга питательных веществ на выполнение тренированными людьми долговременных (несколько месяцев) программ тренировки с отягощениями.
Увеличение работоспособности в отдельном занятии
Углеводы
В связи с тем, что углеводы используются как преимущественный источник энергии при упражнениях с отягощениями, была выдвинута гипотеза, что потребление углеводов перед и/или после занятия увеличит общий объём выполняемой в тренировке работы (17, 23, 24). Предположение основывалось на факте истощения мышечного гликогена во время упражнений с отягощениями, в то же время уменьшались интенсивность и – впоследствии — общий объём работы (измеряемый путём умножения количества поднятого веса и выполненных повторений).
Эксперименты показали уменьшение гликогена скелетных мышц после тренировки с отягощениями (рис. 1) (26, 31, 44). Несмотря на это истощение гликогена, в большинстве исследований потребления углеводов перед занятием не обнаружено увеличение результативности в упражнениях с отягощением (15, 23, 24). Ограниченное количество исследований сообщили об увеличении результативности при потреблении углеводов перед занятием (16), следует отметить, что тренировка была не характерна практически (16 подходов упражнений для нижней части тела, выполняемые в изокинетическом динамометре) и не напоминала «обычную» программу спортивной и оздоровительной тренировки.
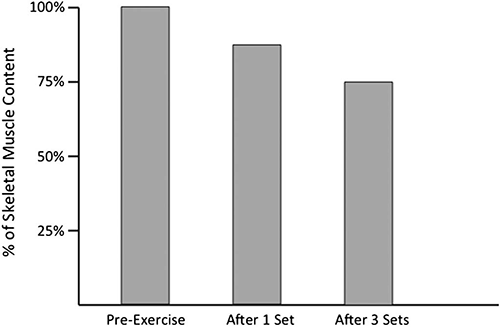
Рис. 1. Истощение гликогена мышц после 1 и 3 подходов сгибаний предплечий (26).
Белки/аминокислоты
Окисление белков (аминокислот) для обеспечения потребностей в энергии незначительно по сравнению с углеводами и жирами. Из 20 аминокислот только 3 окисляются для энергообеспечения упражнений — аминокислоты с разветвлёнными углеводородными цепями (BCAA – лейцин, изолейцин и валин). Даже когда окисляются ВСАА, уровень их окисления для энергообеспечения ниже, чем у жиров и углеводов (22). Согласно опубликованному реферату исследования (9), мужчины получали ВСАА по 40мг/кг массы тела за 30 минут до и сразу после тренировки для нижней части тела (то есть, 80 мг ВСАА на кг массы тела). Упражнения: жим ногами и, вслед за ним, разгибания голени -выполнялись до утомления в 4 подходах с интенсивностью 80% РМ (разового максимума). Авторы сообщили, что ВСАА не оказывают влияния на результативность в упражнении. В связи с ограниченным участием в окислительных процессах во время выполнения упражнений и неспособностью улучшать результаты, аминокислоты не нужно потреблять перед занятием с отягощениями, что не исключает возможного положительного влияния на результативность следующего занятия.
Потребление углеводов и белков
Потребление белков или углеводов отдельно не оказывает положительного влияния на тренировку с отягощениями. В эксперименте, проведённом в Техасском Университете под руководством Ivy, изучали влияние совместного потребления углеводов и белков на результативность упражнений с отягощениями (2). Испытуемые — не тренировавшиеся прежде мужчины, выполняли 3 подхода по 8 повторений до утомления в 7 упражнениях для верхней и нижней части тела. В качестве потребляемых добавок использовали искусственно подслащённый раствор электролитов (плацебо) или напиток, содержащий смесь углеводов и белков (в соотношении 4 : 1) по следующей схеме:
- 30 до упражнений: 26 г углеводов и 6,5 г сывороточного протеина или плацебо
- непосредственно перед упражнениями: 13 г углеводов и 3,2 г сывороточного протеина или плацебо.
Общее количество углеводов и белков, принимаемых в течение 30 минут перед занятием в экспериментальной группе, составило 39 и 10 г соответственно. Результативность в упражнениях с отягощениями измеряли путём подсчёта количества поднятого веса в третьем подходе, выполняемом до отказа в каждом из 7 упражнений. Не обнаружено существенных различий в обеих группах — потреблявшей добавки (534 ± 19кг) и потреблявшей плацебо (556 ± 22кг) (2).
Подводя итог, по-видимому, потребление углеводов и белов отдельно, а также их совместное потребление перед занятием не улучшает результативность тренировки с отягощениями в отношении общего количества поднимаемого веса. Противоположные результаты наблюдаются при потреблении белков и углеводов в отношении кратковременной и долговременной адаптации. Оба эти аспекта будут рассмотрены ниже.
Всасывание липидов
После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (длинноцепочечные жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты диффундируют внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты также здесь могут попадать в энтероциты и далее уходить в кровь воротной вены, однако бóльшая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
Селен-цистеин-содержащая тРНК является производным изопентенилированного аденозина-37 (A37), обычно опосредованного модификацией антикодона в положении 3′ (Moustafa M.E. et al., 2001). Селен-цистеин-содержащая тРНК декодирует UGA, который в физиологических условиях блокирует кодон и обеспечивает включение молекулы селен-цистеин в формирующиеся селенсодержащие пептиды. Отсутствие изопентенилированной тРНК проявляется в снижении эффективности деградации селен-цистеин-содержащей тРНК в декодированных нечувствительных кодонах бактериальных и дрожжевых клеток (Warner G.J. et al., 2000). Таким образом, неточная трансляция сигнала остановки процесса кодирования может привести к преждевременному завершению процесса протеинового синтеза и сборке короткоцепочечных белковых молекул.
Ресинтез липидов в энтероцитах
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, одновременно могут использоваться и эндогенные жирные кислоты, поэтому ресинтезированные жиры отличаются от пищевых и более близки по составу к «своим» жирам. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это, во-первых, ликвидирует их детергентное действие на мембраны и, во-вторых, создает их транспортные формы для переноса по крови в ткани.
Активация жирной кислоты
Поступившая в энтероцит (как и в любую другую клетку) жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
Реакция активации жирной кислоты
Ресинтез эфиров холестерола
Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-SКоА:холестерол-ацилтрансферазы (АХАТ).
Реэтерификация холестерола напрямую влияет на его всасывание в кровь. В настоящее время ищутся возможности подавления этой реакции для снижения концентрации ХС в крови.
Реакция ресинтеза эфиров холестерола
Ресинтез триацилглицеролов
Для ресинтеза ТАГ есть два пути:
Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ.
Моноацилглицеридный путь образования ТАГ
Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется, а глицерол в энтероцитах не задерживается и быстро переходит в кровь, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы. Здесь можно выделить следующие реакции:
- Образование глицерол-3-фосфата из глюкозы.
- Превращение глицерол-3-фосфата в фосфатидную кислоту.
- Превращение фосфатидной кислоты в 1,2-ДАГ.
- Синтез ТАГ.
Глицеролфосфатный путь образования ТАГ
Ресинтез фосфолипидов
Фосфолипиды синтезируются также, как и в остальных клетках организма (см «»). Для этого есть два способа:
Первый путь – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина.
Ресинтез фосфолипидов из ДАГ на примере фосфатидилхолина
Второй путь – на основе синтезируемой in situ фосфатидной кислоты.
Схема ресинтеза фосфолипидов из фосфатидной кислоты
После ресинтеза фосфолипиды, триацилглицеролы, холестерол и его эфиры упаковываются в особые транспортные формы липидов – липопротеины и только в такой форме они способны покинуть энтероцит и транспортироваться в крови. В кишечнике формируются два вида липопротеинов – хиломикроны и липопротеины высокой плотности (ЛПВП), другие типы липопротеинов здесь не образуются.
Образование мицелл
В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, свободные жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер уже около 5 нм). Свободный глицерол всасывается напрямую в кровь.
Схематичное изображение переваривания липидов
Полученные смешанные мицеллы достигают эпителия кишечника и их компоненты диффундируют в клетки и попадают в гладкую эндоплазматическую сеть. Желчные кислоты почти не всасываются и остаются в просвете кишечника. Далее желчные кислоты достигают подвздошной кишки и всасываются там ().
Гистохимические методы определения в тканях
Самым старым методом окрашивания Л. в тканях является метод с использованием четырехокиси осмия (OsO4). Этот реактив восстанавливается непредельными жирными к-тами и целым рядом других веществ, обладающих восстанавливающими свойствами. Продукты восстановления OsO4 окрашены в черный цвет. Однако следует признать, что методы выявления Л. с помощью жирорастворимых красителей более просты и надежны. В гистохимии для этих целей прежде всего стали использовать судан III, несколько позже — судан IV и шарлах. Л. более интенсивно окрашиваются красящими смесями, особенно теми, которые содержат два (или более) гомолога или изомера нафтоловых суданов. Окрашивание Л. жирорастворимыми красителями основано на том, что они растворяются в жировых веществах лучше, чем в обычных растворителях. Термин «суданофилия» означает способность ткани окрашиваться любыми жирорастворимыми красителями.
Для сохранения Л. в тканях при фиксации рекомендуется использовать 10 — 15% р-р формалина, но еще лучше использовать фиксатор формол-кальций по Бейкеру: формалин— 10 мл; 10% хлористый кальций — 10 мл; дистиллированная вода — 80 мл.
К этому фиксатору должен быть добавлен мел, для того чтобы смесь имела нейтральную реакцию. Фиксировать ткань рекомендуется 24—48 час., более длительная фиксация может привести к образованию кристаллов, изменению растворимости Л. и т. д. Отмытая после фиксации ткань промывается в проточной воде; срезы готовятся на замораживающем микротоме. Ткань паренхиматозных органов можно предварительно заключить в желатину.
При окрашивании ткани на Л. дает хорошие результаты и одновременно выявляет суданофильную зернистость в сегментоядерных лейкоцитах метод Гольдмана. Р-р судана III для окраски тканей по этому методу готовится следующим образом: 70% этанол — 100 мл; дистиллированная вода —- 20 мл; альфа-нафтол — 1,2 г; судан III — в избытке.
Смесь кипятят в течение 10 мин. и фильтруют. Срезы ткани красят 15 мин., затем дифференцируют в 70% этаноле, контролируя процесс под микроскопом. Мазки крови фиксируют 3 мин. смесью, состоящей из 1 части формалина и 4 частей 96 % этанола.
При окраске тканей на Л. по методу Чаччо следует маленькие кусочки фиксировать в течение 24—48 час. в смеси следующего состава: 5% водный р-р двухромовокислого калия — 80 мл; формалин — 20 мл; ледяная уксусная к-та — 5 мл.
Затем кусочки ткани выдерживают 5 — 8 дней в 3% двухромовокислом калии («хромируют»), сутки промывают в проточной воде, проводят через этанол восходящих концентраций в течение суток, проводят через ксилол и заключают в парафин. Приготовленные срезы после обработки 70% этанолом красят насыщенным р-ром судана III в 70% этаноле или при температуре 50° красителем следующего состава: 80 % этанол — 95 мл; ацетон — 5 мл; судан III — до насыщения.
После охлаждения жидкость фильтруется. Срезы красят 30 — 60 мин. при температуре 30°, споласкивают 50% этанолом, промывают в дистиллированной воде и заключают в глицерин-желатину.
Ядра клеток можно красить на Л. квасцовым гематоксилином, лучше это делать до обработки срезов су-даном. Л. окрашиваются в оранжевокрасный цвет.
Библиография: Алимова Е. К., Аствацатурьян А. Т. и Жаров Л. В. Липиды и жирные кислоты в норме и при ряде патологических состояний, М., 1975; Биохимические методы исследования в клинике, под ред. А. А. Покровского, М., 1969; Кейтс М. Техника липидологии, пер. с англ., М., 1975; Комаров Ф. И., Коровкин Б. Ф. и Меньшиков В. В. Биохимические исследования в клинике, Л., 1976; Липиды, под ред. С. Е. Северина, М., 1977; Меркулов Г. А. Курс патологогистологической техники, с. 241, Л., 1969; П и р с Э. Гистохимия, пер., с англ., с, 259, М., 19 62; Lipids, ed. by R. Paoletti а. о., v. 1—2, N. Y., 1976; Masoro E. J. Physiological chemistry of lipids in mammals, Philadelphia, 1968; Searcy R. L. Lipopa-thies, Springfield, 1971.
Биосинтез триглицеридов
Фундаментальными кирпичиками процесса выступают глицерин и ЖК. Изначально формируется промежуточный продукт – глицерол-3-фосфат. Это характерно для процессов биосинтеза, происходящих в почках и стенках кишечника. Клетки органов отличаются гиперактивностью фермента глицеролкиназы, чего нельзя сказать о мышечной и жировой ткани. Тут вещество формируется при помощи гликолиза – окисления глюкозы.
Эффект особенно проявляется при истощении. Вследствие этого, образуется недостаток глюкозы, что приводит к резкому снижению производства глицерол-3-фосфата. Как результат свободные ЖК не используются на ресинтез липидов, просто покидая ткань.
Еще одним источником промежуточного синтеза глицерол-3-фосфат выступает печень. Орган может производить вещество обоими способами, с использованием как глицерина, так и глюкозы, в качестве базового соединения. Впрочем, для синтеза глицерол-3-фосфат главное, что события произошли, поскольку в дальнейшем соединение ацилируется. То есть происходит процесс введения RCO- остатка при помощи молекул ЖК (КоА производные).
Это приводит к синтезу фосфатидной кислоты. В дальнейшем от полученного соединения отщепляется остаток фосфорной кислоты. Реакция дефосфорилирования протекает с участием фосфатидатфосфатазы. Ее продуктом выступает 1,2-диглицерид. До получения триглицерида остается единственный шаг. Он состоит в этерификации. Кислотой выступает 1,2-диглицерид, заместителем спирта – фермент ацил-КоА.
Общий принцип биосинтеза липидов
Образование ЖК и их производных начинается с цитоплазмы. Вторая часть биосинтеза – удлинение молекулярной цепи также продолжается в клетке, однако «производственная мастерская смещается» внутрь митохондрии. На каждом этапе, соединение обогащается двумя атомами C, что напоминает процесс бета-окисления, только в его обратной интерпретации.
Говоря более развернуто, в цитоплазме непосредственно и происходит синтез, например пальмитиновой кислоты. Митохондрии же, используют уже готовый «полуфабрикат», для производства полноценных жирных кислот, состоящих из 18-и и более атомов углерода. Выполнить весь биосинтез самостоятельно от «А» до «Я», митохондрии не в состоянии. Причина банальна – «низкий уровень квалификации». Возвращаясь к технической терминологии, митохондрии обладают очень низкой способностью включать меченые уксусные кислоты в длинную цепь липидных структур.