Кетоацидоз
Содержание:
- Диагностика
- История
- Глюкоза — источник энергии в организме
- Эпидемиология
- Профилактика
- 2.Симптомы заболевания
- Сахарный диабет 2 типа — беспомощность инсулина
- Лечение кетоацидоза
- Голодный кетоацидоз: что нужно знать
- Применение инсулина при беременности
- Обменный ацидоз
- Диабетическая кетоацидотическая кома — причины и механизм развития, признаки
- Сахарный диабет у собак и кошек — диагностика заболевания
- Патогенез (что происходит?) во время Диабетической кетоацидотической комы:
- Вывод
Диагностика
Диагностика, безусловно, должна проводиться только комплексно. Обязательна дифференциация СД от болезней, способных вызвать схожие клинические признаки, а также исключение сопутствующих диабету заболеваний. На начальных этапах диагностики желательно провести биохимический и общий клинический анализ крови, а при необходимости – другие дополнительные методы исследований.
Диагностика СД базируется на обнаружении стойкой гипергликемии натощак (более 10 ммоль/л) наряду с глюкозурией. Однократное определение концентрации глюкозы в крови более 10 ммоль/л ни в коем случае не является подтверждением СД, поскольку гипергликемия у кошек является частым последствием стресса в результате высвобождения адреналина (особенно в условиях клиники).
При подозрении на СД (характерные анамнез и симптомы, выявленная гипергликемия) для подтверждения диагноза необходимо определить:
- концентрацию глюкозы натощак в домашних условиях во избежание стресса;
- концентрацию фруктозамина в сыворотке крови. Это измерение является способом оценки средней концентрации глюкозы в крови за предшествующие 1-2 недели;
- концентрацию глюкозы в моче, взятой в домашних условиях (опять же во избежание стресса, вызванного посещением клиники).
История
Первое полное описание диабетического кетоацидоза приписывается Юлиусу Дрешфельду , немецкому патологу , работающему в Манчестере , Великобритания. В своем описании, которое он прочитал на лекции 1886 года в Королевском колледже врачей в Лондоне, он опирался на отчеты Адольфа Куссмауля, а также на описание основных кетонов, ацетоацетата и β-гидроксибутирата, а также их химическое определение. Заболевание оставалось почти повсеместно фатальным до в 1920-х годах; к 1930-м годам смертность упала до 29 процентов, а к 1950-м годам она стала менее 10 процентов. Отек мозга, вызванный DKA, был описан в 1936 году группой врачей из Филадельфии.
Многочисленные исследования с 1950-х годов были сосредоточены на идеальном лечении диабетического кетоацидоза. Значительная часть этих исследований была проведена в Центре медицинских наук Университета Теннесси и Медицинской школе Университета Эмори . Изученные варианты лечения включали высокие или низкие дозы внутривенного, подкожного или внутримышечного (например, « режима Альберти ») инсулина, добавление фосфатов, потребность в нагрузочной дозе инсулина и целесообразность использования бикарбонатной терапии при умеренном ДКА. Остались без ответа различные вопросы, например, действительно ли введение бикарбоната при тяжелом ДКА влияет на клиническое течение и нужна ли ударная доза инсулина взрослым.
Сахарный диабет 2 типа, склонный к кетозу, был впервые полностью описан в 1987 году после нескольких предыдущих описаний случаев. Первоначально считалось, что это форма диабета зрелого возраста у молодых , и до этого он получил несколько других описательных названий (например, «идиопатический диабет 1 типа», «диабет Флэтбуша», «атипичный диабет» и «диабет 1,5 типа»). была принята нынешняя терминология «диабет 2 типа, склонный к кетозу».
Глюкоза — источник энергии в организме
Для нормальной работы клеткам нужна энергия, основной источник которой — углеводы. Они содержатся почти во всех продуктах питания.
В кишечнике углеводы расщепляются до простых соединений (моносахаридов, например глюкозы), всасываются слизистой и попадают в кровь. Организм всегда готов отреагировать на изменение уровня глюкозы. В этом ему помогают некоторые рецепторы и сигнальные молекулы–пептиды. В здоровом теле эта реакция происходит быстро и в соответствии с изменением уровня глюкозы.
В роли двери выступают рецепторы семейства GLUT — белки на поверхности мембраны клетки. Часть из них открывается автоматически, но большинству нужен ключ — специальный гормон инсулин.
Исключение составляют клетки мозга: это слишком важный орган, чтобы отдавать его энергоснабжение «на аутсорс». Поэтому рецепторы GLUT в клетках головного мозга открываются автоматически, без участия инсулина. Концентрация глюкозы в крови уравнивается с концентрацией в нейронах.
Эпидемиология
Определенные группы населения предрасположены к развитию кетоацидоза, включая людей с диабетом, людей с длительным и тяжелым употреблением алкоголя, беременных женщин, кормящих женщин, детей и младенцев.
Люди с диабетом, которые производят очень мало инсулина или не вырабатывают его вообще, предрасположены к развитию кетоацидоза, особенно в периоды болезни или пропущенных доз инсулина. Сюда входят люди с диабетом 1 типа или склонным к кетозу диабетом.
Продолжительное употребление алкоголя — это риск кетоацидоза, особенно у людей с плохим питанием или сопутствующим заболеванием.
У беременных женщин высокий уровень гормонов, включая глюкагон и плацентарный лактоген человека, которые увеличивают циркуляцию свободных жирных кислот, что увеличивает выработку кетонов. Кормящие женщины также предрасположены к увеличению выработки кетонов. Эти группы населения подвержены риску развития кетоацидоза в условиях метаболических стрессоров, таких как голодание, низкоуглеводная диета или острое заболевание.
Дети и младенцы имеют более низкие запасы гликогена и могут вырабатывать высокие уровни глюкагона и контррегулирующих гормонов во время острых заболеваний, особенно желудочно-кишечных заболеваний. Это позволяет детям и младенцам легко вырабатывать кетоны и, хотя и редко, может прогрессировать до кетоацидоза при остром заболевании.
Профилактика
Приступы DKA можно предотвратить до некоторой степени у лиц, страдающих диабетом, путем соблюдения «правил больничного дня»; это четкие инструкции для человека о том, как лечить себя, когда он нездоров. Инструкции включают советы о том, сколько дополнительного инсулина нужно принимать при неконтролируемом уровне сахара, о легкоусвояемой диете, богатой солью и углеводами, о средствах для подавления лихорадки и лечении инфекции, а также о том, когда следует обращаться за медицинской помощью.
Люди с диабетом могут контролировать свой собственный уровень кетонов при плохом самочувствии и обращаться за помощью, если они повышены.
2.Симптомы заболевания
При остром диабетическом кетоацидозе наблюдаются проблемы с дыханием и отек мозга. Существует риск наступления комы и даже смерти.
Уровень сахара в крови может стать достаточно высоким, прежде чем вы заметите симптомы кетоацидоза, которые включают:
- Покраснение кожи (горячая и сухая кожа).
- Нарушение зрения.
- Чувство жажды.
- Сонливость или трудности при пробуждении. Маленькие дети могут не испытывать интереса к своей обычной деятельности.
- Частое и глубокое дыхание.
- Сильный фруктовый запах изо рта.
- Потеря аппетита, боли в животе, рвота.
- Дезориентация во времени и в пространстве.
Сахарный диабет 2 типа — беспомощность инсулина
Сахарный диабет 2 типа (СД2) — многофакторное заболевание, в развитии которого играют роль как генетические факторы, так и образ жизни. На него приходится 90% случаев заболевания сахарным диабетом.
СД2 развивается из-за низкой чувствительности клеток к инсулину, на фоне которой нормальное количество инсулина становится недостаточным. Если сахарный диабет 1 типа начинается после гибели бета-клеток, то при сахарном диабете 2 типа клетки островков Ларгенганса продолжают функционировать, по крайней мере на момент манифестации.
Они продолжают производить инсулин, который так же поступает к клеткам, однако домофон–рецептор перестает на него реагировать. Глюкоза не может попасть в клетку и скапливается у «двери». Такое состояние называется устойчивостью к инсулину или инсулинорезистентностью.
Основная причина заболевания — ожирение. Примерно у трети людей с избыточным весом развивается сахарный диабет 2 типа. К другим факторам, которые повышают риск, относится малоподвижный образ жизни, диета с большой долей жиров и простых углеводов, скопление жировой ткани в области живота, наследственная предрасположенность, возраст.
Классические симптомы сахарного диабета 2 типа похожи на симптомы СД1 — та же хроническая усталость, жажда и обильное мочеиспускание, снижение веса, не связанное с образом жизни, помутнение зрения.
Ранние симптомы, которые также встречаются при сахарном диабете 2 типа:
- Медленное заживление ран и порезов;
- Онемение, покалывание или боль в руках и ногах;
- Кожные инфекции;
- Потемнения кожи в области подмышек, шеи и паха.
Наличие одного из этих признаков — повод обратиться к врачу.
СД2 может развиваться годами и оставаться незамеченным. Чтобы как можно раньше обнаружить признаки сахарного диабета, можно заполнять специальные опросники, а после 40 лет — проходить ежегодное скрининговое обследование.
Профилактическая проверка рекомендуется людям, у которых лишний вес сочетается с одним из следующих факторов:
- Диагноз сахарный диабет 2 типа у родственника;
- Сердечно-сосудистые заболевания в истории болезни;
- Повышенный уровень холестерина в крови;
- Высокое артериальное давление;
- Малоподвижный образ жизни;
- Гестационный диабет во время беременности или роды крупного ребенка (более 3600 г).
В отличие от сахарного диабета 1 типа, риском СД2 можно управлять. Правильное питание, нормальный вес и 150 минут упражнений в неделю снижают риск сахарного диабета 2 типа даже при генетической предрасположенности.
Рекомендуется также сократить время, проведенное в положении сидя. Если у вас сидячая работа — делайте короткие перерывы с разминкой в течение дня, а в обед можно устроить прогулку.
Сахарный диабет 2 типа нельзя полностью вылечить, можно только замедлить его развитие и контролировать осложнения. На ранних стадиях достаточно изменить образ жизни, чтобы обратить ситуацию в свою сторону. Иногда врач может назначить препараты, которые улучшают чувствительность к инсулину и откладывают развитие заболевания.
В следующей части мы подробнее расскажем, как на риск развития сахарного диабета 2 типа влияет генетика и микробиота кишечника.
Лечение кетоацидоза
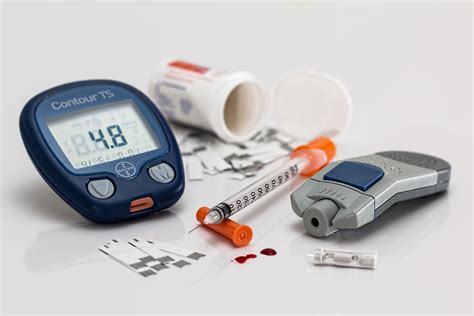
Кетоацидоз — опасное состояние, требующее незамедлительного лечения. Цель лечения состоит в восстановлении водного и калиевого баланса в организме, снижении кислотности крови путем избавления от кетонов и снижении уровня глюкозы до нормального (примерно 5-8 ммоль/л).
Перед началом лечения врач определяет уровень в крови глюкозы, кислот, калия и кетонов, а также другие параметры. Даже при потере значительного количества калия, первоначальные его показатели могут быть в пределах нормы. По мере лечения в клетки вашего организма поступает больше калия для возмещения в них потерь, поэтому в крови уровень калия может даже понизиться. В этом случае врач назначает дополнительный прием калия.
Поскольку при кетоацидозе наблюдается нехватка инсулина, гормон вводят внутривенно. Существует риск возникновения гипогликемии, в случае которой назначается еще одна внутривенная инъекция глюкозы и раствора соли калия. Подробный медицинский протокол лечения диабетического кетоацидоза читайте здесь — http://diabet-med.com/diabeticheskij-ketoacidoz/.
По мере того как уровень инсулина нормализуется, организм прекращает расщеплять жир для получения энергии и возвращается к питанию глюкозой. Состояние больного улучшается по мере того, как из организма выводятся кетоны.
Поскольку при кетоацидозе больной теряет около 6—8 литров жидкости, ему внутривенно вводят большие объемы водно-солевого раствора. Пополнение запасов жидкости в организме избавляет от тошноты и рвоты, возвращая возможность употреблять жидкость и твердую пищу. Восстанавливается нормальная умственная деятельность и способность самостоятельно вводить инсулин и контролировать свою диету. К этому времени обычно устанавливается причина, вызвавшая кетоацидоз (например, поломка инсулинового насоса или инфекционное заболевание).
В большинстве случаев кетоацидоз хорошо поддается лечению. Но, к сожалению, в 10% случаев, особенно когда он развивается у пожилых диабетиков и диабетиков, страдающих другими заболеваниями, затрудняющими лечение, он ведет к летальному исходу
Чтобы устранить кетоацидоз и не допустить развития осложнений, важно вовремя обратиться к врачу, как, впрочем, и в случае любого другого осложнения диабета
Голодный кетоацидоз: что нужно знать
Голодный кетоацидоз возникает, когда человек претерпел длительный период голодания. Во время голодного кетоацидоза жирные кислоты заменяют глюкозу в качестве основного источника топлива для организма.
Голодный кетоацидоз встречается редко, но у некоторых риск его развития выше, чем у других. В группу повышенного риска входят больные расстройствами пищевого поведения.
Голодный кетоацидоз может быть серьезным заболеванием, если не обращаться за лечением, и даже может привести к смерти.
В этой статье более подробно обсуждается голодный кетоацидоз, включая его симптомы, а также способы его лечения и профилактики.
Применение инсулина при беременности
Рискам развития сахарного диабета на фоне беременности, равно как и ведению беременности у женщины с уже подтвержденным диагнозом, уделяется особое внимание. К общим рекомендациям относят:
ведение беременности специалистами из разных областей медицины (акушер-гинеколог, эндокринолог, диетолог, возможно прочие);
соблюдение специально разработанной диеты — калорийность суточного рациона рассчитывается в 30-35 ккал/кг идеальной массы тела (в среднем 1800-2400 ккал); 40-45% калорийности отводится на углеводы, 20-30% — на белки и 30% — на жиры; важно исключить легкоусвояемые углеводы, принимать пищу 5-6 раз в день с 2-3-часовыми интервалами; прибавка массы тела не должна превышать 10 кг, а при наличии ожирения — 7 кг;
соблюдение режима физической активности, избегание чрезмерных физических и эмоциональных усилий;
посещение женской гинеколога и эндокринолога дважды в неделю в первой половине беременности и еженедельно во второй;
проведение УЗИ на 15-20 неделе для исключения грубых пороков развития, на 20-23 неделе для исключения пороков сердца, на 28-32 неделе для раннего выявления макросомии, задержки внутриутробного развития плода, оценки объема околоплодных вод, в канун родов для исключения макросомии плода и решения вопроса о тактике ведения родов;
определение уровня альфа-фетопротеина в сыворотке крови на 15-20 неделе, периодическое определение уровня гликолизированного гемоглобина, повторная офтальмоскопия в третьем триместре для решения вопроса о возможности физиологического ведения родов.
Выбору сахароснижающих препаратов для назначения беременным отводится особое внимание. Пероральные сахароснижающие препараты не рекомендованы, а потому инсулин оказывается единственным сахароснижающим средством в данной ситуации
На сегодняшний день инсулин лизпро по риску применения во время беременности относят к классу В, а инсулин аспарт и инсулин гларгин — к классу С; их использование во время беременности остается темой для обсуждений.
Гестационный сахарный диабет изначально является поводом для компенсирующей диетотерапии и лишь при неэффективности диетических мероприятий назначается инсулинотерапия, идеальный — интенсивная схема.
При наличии у беременной сахарного диабета в анамнезе (любого типа) интенсивная инсулинотерапия является методом выбора, поскольку способна предотвратить неблагоприятное воздействие гипергликемии на организм матери и ребенка. Традиционно введение инсулина осуществляют с помощью инсулиновых шприцев (используют флаконы с концентрацией инсулина 100 ЕД/мл).
Адекватно составленная инсулинотерапия женщине в период беременности позволяет предотвратить развитие осложнений и у нее, и у плода. Цель таковой — максимально приблизить обмен глюкозы к нормальному и не допустить при этом гипергликемии, кетоацидоза или тяжелой гипогликемии.
Поддержание уровня глюкозы в крови обеспечивается посредством применения человеческого инсулина. Начальную дозу инсулина рассчитывают с учетом массы тела женщины и срока беременности. Так, в I триместре она может быть равна 0,6 ЕД/кг, во II триместре — 0,7 ЕД/кг и в III триместре — 0,8 ЕД/кг. Для беременных с низкой массой тела начальные суточные дозировки препарата могут составлять 0,4; 0,5 и 0,6 ЕД/кг соответственно триместрам.
Обычно 2/3 общей суточной дозы инсулина вводят перед завтраком, 1/3 — перед ужином. Примерно треть утренней дозы приходится на инсулин короткого действия, 2/3 — на инсулин средней длительности действия.
В период родовой деятельности показано применение дробных дозировок инсулина с параллельным контролем гликемии, коррекцией ее уровня 5%-ым раствором глюкозы внутривенно. В день родов начальная доза инсулина может составлять ¼ от суточной с последующим внутривенным введением по 2-3 ЕД/ч вместе с 100-150мл 5%-ого раствора глюкозы и параллельным контролем гликемии. После родов дозу инсулина вдвое-втрое уменьшают.
При оперативном родоразрешении в день операции больную не кормят и ей не вводят инсулин. Во время операции при гликемии менее 8 ммоль/л инсулин не вводят, а при гликемии более 8 ммоль/л коррекцию производят простым инсулином короткого действия. На 4-5-е сутки после операции больную переводят на препараты пролонгированного действия.
Обменный ацидоз
Обменный ацидоз — наиболее часто встречающаяся форма нарушения кислотно-щелочного равновесия крови. Причины, приводящие к развитию обменного ацидоза вследствие избыточного накопления кислот в организме, многочисленны. Одна из них — кетоацидоз — неполное окисление жиров и избыточное накопление ацетоновых тел (ацетоуксусной, бета-оксимасляной кислот), напр, при осложненном течении сахарного диабета или при голодании. В этих условиях образующиеся кетоновые тела не успевают окисляться в тканях и выделяются в значительном количестве почками. При этом организм теряет одновременно большое количество Na+ и К+, так как выделение их происходит в виде натриевых и калиевых солей. Однако способность почек выделять последние ограниченна, в результате чего постепенно происходит их избыточное накопление в крови и тканях, в связи с чем pH крови снижается.
Обменный ацидоз может наблюдаться и при неполном окислении углеводов в связи с накоплением в тканях молочной кислоты. Развитие ацидоза подобного характера наблюдается при усиленной физической работе, при гипоксических состояниях различного характера (см. Гипоксия), при острой сердечной недостаточности (кардиогенный шок), при тяжелых поражениях печени (циррозы, токсическая дистрофия), при длительных лихорадочных состояниях и т. д.
При заболеваниях почек (почечная недостаточность) возникает азотемический ацидоз, связанный с избыточным накоплением в крови и тканях фосфатов, сульфатов, анионов органических кислот. Нарушение функции почек приводит к уменьшению выведения последних при неизмененном или увеличенном выведении катионов. Это состояние, как правило, возникает при уремии. Причиной обменного ацидоза может быть также избыточное экзогенное введение кислот в организм, в частности при отравлении уксусной кислотой, длительном или бесконтрольном приеме салицилатов, хлористого аммония, соляной кислоты и т. д.
Вторую группу причин представляют факторы, приводящие к избыточной потере анионов HCO3— в организме либо через почки, либо через желудочно-кишечный тракт, как это имеет место при продолжительных поносах, свищах кишечника, желчного и панкреатического протоков, когда организм теряет значительное количество бикарбоната натрия и калия с соками поджелудочной железы и кишечника, а также с желчью. Для обменного ацидоза почечного происхождения, при котором нарушается канальцевая реабсорбция бикарбоната натрия, характерно выделение большого количества бикарбонатов с мочой. Примером обменного ацидоза почечного происхождения является ацидоз, возникающий при поздних токсикозах беременности (см. Нефропатия беременных).
Компенсация обменного ацидоза осуществляется при помощи буферных систем крови и физиологических механизмов компенсации (легкие, почки). Действие буферных систем, и главным образом бикарбонатного буфера, сводится в первую очередь к нейтрализации избытка кислот. Реакция происходит по схеме H+ + AH+ + NaHCO3 = H2CO3 + NaAH.
В результате этой реакции из сильной нелетучей кислоты образуются слабая угольная кислота и соль нелетучей кислоты. Буферная емкость крови постепенно снижается, и содержание бикарбоната натрия уменьшается до 2,9—10 мэкв/л (при норме 20—26 мэкв/л).
Образующаяся при этом в избытке CO2 выводится через легкие, чему способствует так наз. компенсаторная одышка — гипервентиляция, возникающая в результате непосредственного воздействия повышенной концентрации водородных ионов и избытка CO2 на дыхательный центр (легочный механизм компенсации). Выведение кислот и восстановление концентрации бикарбоната натрия в плазме при нормальной функции почек происходит за счет увеличения фильтрации некоторых органических кислот (пировиноградной, ß-оксимасляной, ацетоуксусной) и изменения метаболизма в эпителии почечных канальцев, что приводит в конечном итоге к увеличению содержания ионов водорода в моче и повышению реабсорбции бикарбоната. Оба этих механизма почечной компенсации в конечном итоге приводят к увеличению титруемой кислотности мочи. Сдвиг в сторону преобладания в моче кислых фосфатов обусловливает характерное для обменного ацидоза понижение pH мочи. При длительном течении обменного ацидоза в канальцевом эпителии усиливается процесс образования и поступления в мочу аммония, где он связывает ион водорода и хлора, образуя хлористый аммоний (NH3 + H+ + NaCl = NH4Cl + Na+). При помощи этого механизма связывания иона водорода последний выводится в большом количестве без дальнейшего снижения pH мочи.
Диабетическая кетоацидотическая кома — причины и механизм развития, признаки
Данный вид осложнения развивается при абсолютной или относительной недостаточности инсулина в организме, а также при нарушении утилизации глюкозы тканями, которое развивается у больных с тяжелой формой инсулинзависимого сахарного диабета. Кетоацидотическое состояние развивается неожиданно, но обычно ему предшествует ряд провоцирующих стресс-факторов, таких как неверно подобранная доза инсулина, смена препарата, прекращение введения инсулина по какой-либо причине, грубое нарушение диеты, злоупотребление алкоголем, нарушение техники введения инсулина, повышение потребности в инсулине из-за особенностей состояния организма (беременность, отравление, хирургическое вмешательство, инфекции и др.).
Развитие кетоацидоза связано с тем, что при нехватке инсулина в организме нарушается процесс проникновения глюкозы в клетки, что в свою очередь приводит к энергетическому обеднению тканей, способствующему дисфункции органов. Несмотря на компенсаторную гипергликемию, развивающуюся из-за усиления выработки адренокортикотропного, соматотропного и других гормонов, а также увеличения выработки глюкозы в печени, из-за отсутствия достаточного количества инсулина глюкоза не может проникнуть через клеточный барьер. В связи с этим в компенсаторных целях для поддержания гомеостаза организм начинает получать недостающую энергию путем активного расщепления жиров — липолиза, а в результате такого биохимического процесса образуются кетоновые тела (ацетон), избыточное количество которого оказывает угнетающее действие на центральную нервную систему, вследствие чего развивается кетоацидотическая кома.
Концентрация кетоновых тел в крови у здоровых людей находится в диапазоне до 100 мкмоль/л, тогда как в моче можно обнаружить лишь следы ацетона. Если течение сахарного диабета переходит в стадию декомпенсации, в печени из-за метаболических изменений образуется большое количество кетоновых тел (до 1000 ммоль/л за сутки). Такое количество кетоновых тел не может быть выведено из организма мышцами и почками, поэтому их скопление приводит к кетоацидозу. Усугубляет состояние образование порочного круга, когда в результате развития кетоацидоза в крови отмечается снижение уровня иммунореактивного инсулина, относительная или абсолютная недостаточность инсулина только нарастает.
Развитие кетоацидотической комы обычно медленное — от нескольких дней до нескольких недель. Если процесс развивается на фоне острых инфекционных заболеваний или тяжелых интоксикаций, диабетическая кома может развиться и за несколько часов. Как правило, клинически диабетический кетоацидоз проходит три стадии, которые при отсутствии своевременной коррекции следуют одна за другой.
1. Стадия умеренного кетоацидоза — больной может предъявлять жалобы на общую слабость, повышенную утомляемость, шум в ушах, вялость, снижение аппетита, чувство жажды, тошноту, острые боли в животе, увеличение объема выделяемой мочи. Выдыхаемый воздух и моча имеют запах ацетона. В крови и в моче обнаруживается увеличение уровня сахара.
2. Стадия прекомы или декомпенсированного кетоацидоза — аппетит у больных исчезает вовсе, помимо тошноты отмечается рвота, которая усиливает общую слабость. Больной безучастен к происходящему вокруг, у него ухудшается зрение, появляется одышка, боли в области сердца и живота. На фоне неукротимого чувства жажды отмечается учащение позывов к мочеиспусканию, что объясняется нарушением водно-электролитного баланса и чрезмерным выведением из организма электролитов — ионов калия, натрия и т.п. Сознание больных сохраняется, так же как и ориентация в пространстве и времени, но отмечается заторможенность при попытке ответить на вопросы. Кожные покровы сухие, шершавые, холодные. Щеки с легким румянцем, а язык покрыт коричневым налетом, на нем могут быть видны отпечатки зубов. Данная стадия может длиться от нескольких часов до нескольких дней. При отсутствии своевременной коррекции подобного состояния наблюдается ухудшение реакции пациентов и переход процесса в заключительную стадию.
3. Стадия комы — больной при этом абсолютно безучастен, может впасть в глубокий сон. При осмотре выявляется глубокое, шумное дыхание с резким запахом ацетона в выдыхаемом воздухе, снижение артериального давления, частый ритмичный пульс. Сухожильные рефлексы постепенно угасают. Отмечается снижение температуры тела.
При подозрении на развитие кетоацидотической комы больного следует незамедлительно госпитализировать с целью проведения необходимого комплекса реанимационных мероприятий.
Сахарный диабет у собак и кошек — диагностика заболевания
Отсутствие действия инсулина приводит к гипергликемии. При гипергликемии, превышающей почечный порог (10 ммоль/ у собак и 15,5 ммоль/л у кошек), реабсорбция глюкозы в проксимальных почечных канальцах становится неполной и развивается гликозурия. Глюкоза действует как осмотический агент, и развивается полиурия. А затем и полидипсия как компенсация потерь жидкости с мочой.
Наиболее распространенными клиническими признаками являются полиурия и полидипсия, потеря веса, повышение аппетита. У собак также встречается диабетическая катаракта, которая лечится хирургически после стабилизации состояния животного. Так же могут наблюдаться вялость, слабость, дегидратация, слепота (собаки), стопохождение (кошки) и запах ацетона при дыхании у пациентов с диабетическим кетоацидозом.
Большинство собак и кошек с сахарным диабетом имеют сопутствующие заболевания. Это инфекции мочевыводящих путей, острый панкреатит, неоплазии. Возможен также гиперадренокортицизм, гипотиреоз у собак, инфекции, хроническая почечная недостаточность, гипертиреоз у кошек.
Для постановки окончательного диагноза необходимо наличие клинических признаков, данных физикального обследования, стойкой гипергликемии и глюкозурии.
Сахарный диабет у собак и кошек необходимо дифференцировать от других заболеваний и состояний с похожей симптоматикой. При полиурии/полидипсии это почечная недостаточность, заболевания печени, гиперкальциемия, гипокалиемия, реакция на введение препаратов (глюкокортикоиды, мочегонные, противосудорожные). Гиперадренокортицизм, гипоадренокортицизм, пиометра, несахарный диабет, психогенная полиурия, полицитемия (собаки); гипертиреоз (кошки).
При потере веса и повышении аппетита — желудочно-кишечные паразиты, энтеропатия с потерей белка, нефропатия. Экзокринная недостаточность поджелудочной железы у собак, гипертериоз у кошек.
При гипергликемии — введение препаратов (глюкокортикоиды, прогестерон, мегестролацетат), диэструс, острый панкреатит. Гиперадренокортицизм, феохромоцитома (собаки), стресс, акромегалия (кошки). При глюкозурии — первичная почечная глюкозурия.
Патогенез (что происходит?) во время Диабетической кетоацидотической комы:
В основе развития ДКА лежат следующие патогенетические механизмы: инсулиновая недостаточность (как в результате недостаточного поступления, так и вследствие усиления потребности в инсулине на фоне имеющейся у пациентов с СД 1-го типа абсолютной инсулиновой недостаточности), а также избыточная продукция контринсулярных гормонов (прежде всего, глюкагона, а также кортизола, катехоламинов, гормона роста), что приводит к уменьшению утилизации глюкозы периферическими тканями, стимуляции глюконеогенеза в результате усиленного распада белка и гликогенолиза, подавлению гликолиза в печени и, в конечном итоге, к развитию выраженной гипергликемии. Абсолютный и выраженный относительный недостаток инсулина приводит к существенному повышению концентрации в крови глюкагона – гормона-антагониста инсулина. Поскольку инсулин больше не сдерживает процессы, которые глюкагон стимулирует в печени, продукция глюкозы печенью (суммарный результат распада гликогена и процесса глюконеогенеза) резко усиливается. В то же время утилизация глюкозы печенью, мышцами и жировой тканью при отсутствии инсулина резко снижается. Следствием этих процессов является выраженная гипергликемия, которая нарастает также в связи с повышением сывороточных концентраций других контринсулярных гормонов – кортизола, адреналина и гормона роста.
При недостатке инсулина усиливается катаболизм белков организма, а образующиеся в результате этого аминокислоты также включаются в глюконеогенез в печени, усугубляя гипергликемию. Массивный распад липидов в жировой ткани, также вызванный инсулиновой недостаточностью, приводит к резкому увеличению концентрации свободных жирных кислот (СЖК) в крови. При инсулиновой недостаточности 80% энергии организм получает путем окисления СЖК, что приводит к накоплению побочных продуктов их распада – кетоновых тел (ацетона, ацетоуксусной и бета-оксимасляной кислот). Скорость их образования намного превышает скорость их утилизации и почечной экскреции, вследствие чего концентрация кетоновых тел в крови увеличивается. После истощения буферного резерва почек кислотно-щелочное равновесие нарушается, возникает метаболический ацидоз.
Таким образом, глюконеогенез и его следствие – гипергликемия, так же, как и кетогенез и его следствие – кетоацидоз, являются результатами действия глюкагона в печени в условиях инсулиновой недостаточности. Иными словами, исходной причиной образования кетоновых тел при ДКА является недостаток инсулина, обусловливающий усиленный распад жира в собственных жировых депо. Избыток глюкозы, стимулируя осмотический диурез, приводит к опасной для жизни дегидратации. Если больной больше не может выпивать соответствующее количество жидкости, потеря воды организмом может составлять до 12 л (около 10-15% массы тела, или 20-25% общего количества воды в организме), что ведет к внутриклеточной (на нее приходится две трети) и внеклеточной (одна треть) дегидратации и гиповолемической недостаточности кровообращения. В качестве компенсаторной реакции, направленной на поддержание объема циркулирующей плазмы, увеличивается секреция катехоламинов и альдостерона, что ведет к задержке натрия и способствует усилению выделения калия с мочой. Гипокалиемия – важный компонент метаболических нарушений при ДКА, обусловливающий соответствующие клинические проявления. В конечном итоге, когда недостаточность кровообращения приводит к нарушению почечной перфузии, образование мочи уменьшается, вызывая терминальный быстрый подъем концентрации глюкозы и кетоновых тел в крови.
Вывод
Голодный кетоацидоз — необычная форма кетоацидоза. Он происходит, если регулярно не потреблять достаточное количество пищи, или организм не может правильно усваивать питательные вещества.
Врач может проверить наличие голодного кетоацидоза с помощью анализов крови и должен будет наблюдать за пациентом, когда он снова начнет есть.
Большинство здоровых людей не подвергаются риску. Однако те, кто страдает расстройствами пищевого поведения, и те, кто прошел определенные медицинские процедуры, могут иметь более высокий риск развития голодного кетоацидоза.
Полное выздоровление обычно возможно после лечения.