Дефицит антитромбина iii: причины, симптомы, диагностика, лечение
Содержание:
- Функция
- Режим дозирования
- Агрегация тромбоцитов
- Диагностика тромбофилии
- Наши врачи
- Лечение
- Наши услуги в флебологии
- Особые указания
- Расщепленный и латентный антитромбин
- Антитромбин и гепарин
- Медицинские офисы KDLmed
- Описание
- Симптомы проявления побочных эффектов
- Влияние гликозилирования на активность
- Фармакологические свойства
- Номенклатура
Функция
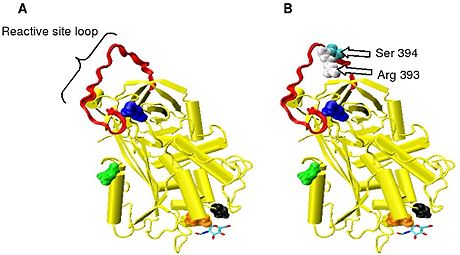 Рис. 2. Реактивная связь arg 393 — ser 394 расположена на открытой петле на поверхности молекулы. Эта петля называется петлей реактивного узла (RSL) или петлей реактивного центра (RCL).
Рис. 2. Реактивная связь arg 393 — ser 394 расположена на открытой петле на поверхности молекулы. Эта петля называется петлей реактивного узла (RSL) или петлей реактивного центра (RCL).
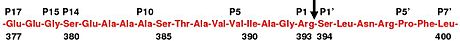 Фигура 3. Показана аминокислотная последовательность петли реактивного сайта антитромбина человека. Петля реактивного сайта содержит аминокислотные последовательности с номерами от 377 до 400 (номера показаны под последовательностью выше) или аминокислоты от P1 до P17 и от P1 ‘до P7’ с использованием соглашения Шехтера и Бергера (номер показан над последовательностью выше). Реактивная связь обозначена стрелкой.
Фигура 3. Показана аминокислотная последовательность петли реактивного сайта антитромбина человека. Петля реактивного сайта содержит аминокислотные последовательности с номерами от 377 до 400 (номера показаны под последовательностью выше) или аминокислоты от P1 до P17 и от P1 ‘до P7’ с использованием соглашения Шехтера и Бергера (номер показан над последовательностью выше). Реактивная связь обозначена стрелкой.
Антитромбин представляет собой серпин (ингибитор сериновой протеазы) и, таким образом, подобен по структуре большинству других ингибиторов протеазы плазмы , таких как альфа-1-антихимотрипсин , альфа-2-антиплазмин и кофактор гепарина II .
Физиологические протеазы- мишени антитромбина — это протеазы (ранее известный как внутренний путь), а именно активированные формы фактора X (Xa), фактора IX (IXa), фактора XI (XIa), фактора XII (XIIa). и, в большей степени, фактор II (тромбин) (IIa), а также активированная форма фактора VII (VIIa) пути (ранее известного как внешний путь). Ингибитор также инактивирует калликреин и плазмин , которые также участвуют в свертывании крови. Однако он инактивирует некоторые другие сериновые протеазы, которые не участвуют в коагуляции, такие как трипсин и субъединица C1s фермента C1, участвующего в классическом пути комплемента .
Инактивация протеазы является следствием захвата протеазы эквимолярным комплексом с антитромбином, в котором активный центр фермента протеазы недоступен для его обычного субстрата . Образование комплекса антитромбин-протеаза включает взаимодействие между протеазой и специфической реактивной пептидной связью внутри антитромбина. В антитромбине человека эта связь находится между аргинином (arg) 393 и серином (ser) 394 (см. Рисунок 2 и рисунок 3 ).
Считается, что ферменты протеазы попадают в неактивные комплексы антитромбин-протеаза в результате их атаки на реактивную связь. Хотя атака аналогичной связи внутри нормального субстрата протеазы приводит к быстрому протеолитическому расщеплению субстрата, инициирование атаки на реактивную связь антитромбина вызывает активацию антитромбина и захват фермента на промежуточной стадии протеолитического процесса. Со временем тромбин способен расщепить реактивную связь в антитромбине, и неактивный комплекс антитромбин-тромбин будет диссоциировать, однако время, необходимое для этого, может быть больше 3 дней. Однако связи P3-P4 и P1′-P2 ‘могут быстро расщепляться эластазой нейтрофилов и бактериальным ферментом термолизином , соответственно, в результате чего неактивные антитромбины больше не могут ингибировать активность тромбина.
Скорость ингибирования антитромбином активности протеазы значительно увеличивается за счет его дополнительного связывания с гепарином , как и его инактивация эластазой нейтрофилов .
Режим дозирования
Агрегация тромбоцитов
Ещё одним анализом, результаты которого важны при назначении лекарственных средств, влияющих на свертывание крови, является оценка агрегации тромбоцитов с разными индукторами.
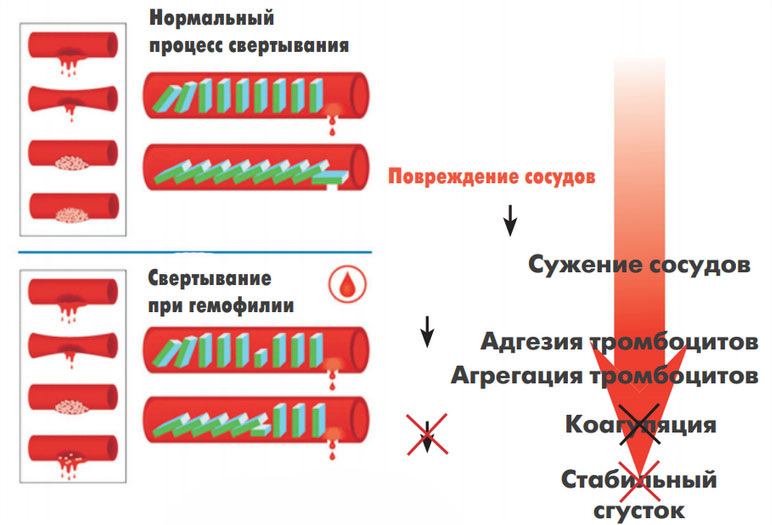
Повторюсь, что запуск системы свёртывания состоит из двух этапов. Первичный этап свёртывания крови – клеточный. В результате клеточного этапа происходит склеивание тромбоцитов друг с другом с образованием первичного рыхлого тромба. Образование тромба сопровождается выбросом в кровь биологически активных веществ, запускающих каскадные ферментные реакции. И это уже второй этап – плазменный или молекулярный. Плазменный этап приводит к образованию окончательного тромба, состоящего из полимерного белка фибрина.
При снижении функции тромбоцитов на первом этапе может повышаться риски кровотечений.При появлении отклонений на втором этапе возможно состояние избыточной свёртываемости крови или тромбофилия. Именно изменения в работе плазменного звена гемостаза даёт риски нарушений плацентарной функции.
Оценить снижение функции тромбоцитов с разных сторон, и, как следствие, риск развития кровотечения, необходимо до назначения лечения. Для этого используется метод агрегации тромбоцитов с разными индукторами – АДФ, арахидоновая кислота, адреналин, ристоцетин.
Три первых индуктора позволяют оценить функцию тромбоцитов c разных сторон, они дополняют друг друга.
Агрегация с ристоцетином позволяет заподозрить опасное по кровотечениям состояние – болезнь Виллебранда, то есть дефицит фактора фон Виллебранда. При планировании беременности этот анализ важен для исключения риска кровотечения в родах.Изменения агрегации тромбоцитов на фоне лечения тромбо Асс и гепарином не связано с избыточным риском кровотечения и сохраняется 3-4 недели после прекращения приёма препаратов.
Анализ на агрегацию тромбоцитов рекомендуется в следующих случаях:
* при невынашивании беременности
* неудачных попытках ЭКО
* тяжелых осложнениях беременности в анамнезе
* бесплодии неясного генеза
* а также при повышенной кровоточивости.
Повышенная кровоточивость проявляется в легком образовании синяков, носовых кровотечениях.
Агрегация тромбоцитов резко меняется сразу после начала лечения препаратами, влияющими на свертываемость крови, и остается измененной еще несколько недель. Поэтому лучше всего ее проверять ДО начала лечения и ДО беременности, потому что во время беременности и на фоне лечения расшифровка результатов анализов затруднительна.
Диагностика тромбофилии
Диагностика данного заболевания требует проведения лабораторных исследований. Как правило, обследование на наличие тромбофилии проводят в следующих случаях:
- наличие данного заболевания у родственников;
- эпизод тромбоза глубоких вен (ТГВ) или в молодом возрасте при отсутствии состояний, которые провоцируют развитие осложнений;
- рецидивы (ТГВ);
- здоровых поверхностных вен;
- 2 или 3 непоследовательных аборта на любом сроке беременности, потеря плода на сроке беременности более 20-ти недель.
Наши врачи
Дроздов Сергей Александрович
Врач сердечно-сосудистый хирург, флеболог, доктор медицинских наук
Стаж 47 лет
Записаться на прием
Константинова Галина Дмитриевна
Врач сердечно-сосудистый хирург, флеболог, доктор медицинских наук, профессор
Записаться на прием
Малахов Юрий Станиславович
Врач — сердечно-сосудистый хирург, флеболог, Заслуженный врач РФ, доктор медицинских наук, врач высшей категории
Стаж 36 лет
Записаться на прием
Лечение
Лечение тромбофилии назначается индивидуально при обязательном участии гематолога и напрямую зависит от факторов, которые привели к появлению этого заболевания. Оно направлено на борьбу с тромбозами и терапию основного заболевания.
Консервативные методы лечения предусматривают комплексный подход, при котором особое внимание уделяется устранению причины возникновения патологии. Помимо этого применяется общая схема лечения и профилактики тромбоза
Это обусловлено тем, что специфической терапии для лечения тромбофилии не существует. Лечение заключается в следующем:
- Назначение диеты, при которой ограничивают потребление жирной и жареной пищи и полностью исключают продукты с высоким содержанием холестерина;
- Приём лекарственных препаратов, угнетающих агрегацию тромбоцитов («Аспирин», «Курантил»), антикоагулянтов («Варфарин»), средств, оказывающих укрепляющее действие на сосудистые стенки («Папаверин», «Трентал»);
- Применение средств народной медицины: свежевыжатого сока винограда, клюквенного чая, настойки семян японской софоры.
Лечение тромбофилии, возникшей вследствие дефицита факторов свёртывания и антитромбина III, предусматривает переливание больших объёмов плазмы, которые сочетают со введением в кровь «Гепарина».
Врождённая тромбофилия, возникающая из-за нехватки антитромбина III требует применения заместительной терапии: введение в кровь препаратов с антитромбином III через три часа после введения «Гепарина». Лечение лёгких форм тромбофилии осуществляется путём подкожного введения лиофилизированной плазмы и «Гепарина» по 4 раза в сутки. Неплохих результатов позволяет добиться внутривенное введение антитромбина ІІІ.
Наши услуги в флебологии
| Название услуги | Цена в рублях |
|---|---|
| Прием врача хирургического профиля (первичный, для комплексных программ) | 2 700 |
| Прием врача-сердечно-сосудистого хирурга (флеболога), д.м.н. Малахова Ю.С. с ультразвуковым исследованием (первичный) | 4 500 |
| Дуплексное сканирование вен обеих нижних конечностей | 6 000 |
| Дуплексное сканирование вен одной нижней конечности | 3 500 |
- Тромбоз глубоких вен
- Венозные трофические язвы
Особые указания
При производстве препаратов, изготовляемых из крови человека, нельзя полностью исключить риск возникновения заболеваний, вызванных переносом инфекционных возбудителей, в т.ч. неизвестного происхождения, при введении препарата. Поэтому доноры отбираются по строгим критериям, проводится исследование и отбор взятой плазмы, а также лабораторный контроль пулов плазмы (Программа безопасности плазмы). Процесс производства препарата Антитромбин III человеческий включает специальные методы обработки, направленные на удаление и инактивацию вирусов (десятичасовое нагревание раствора при (>60°С).
Для производства препарата Антитромбин III человеческий применяется плазма только здоровых доноров, обследование которых на антитела к вирусам ВИЧ-1, ВИЧ-2, гепатита С (HCV), а также поверхностный антиген вируса гепатита В (HbsAg), дало отрицательные результаты. Уровень печеночных трансаминаз (АЛТ) у доноров не превышает допустимых значений. Образцы пула плазмы, кроме обычных методов, исследуются также на антитела к ВИЧ, HCV и HbsAg. Кроме того, проводится исследование на вирусные геномы ВИЧ, HBV, HCV методом полимеразной цепной реакции (ПЦР). ПЦР является высокочувствительным методом, который, в отличие от исследования на наличие антител, позволяет обнаруживать непосредственно геном вируса. В процесс производства допускаются только те образцы плазмы, в которых при ПЦР анализе не выявлено вирусных геномов.
Кроме того, согласно Программе Безопасности Плазмы проводится карантинизация каждой дозы плазмы и ретроспективный анализ, что обеспечивает полный контроль за отводом доноров.
Эффективность предпринимаемых в процессе производства мер безопасности была продемонстрирована в исследованиях с ВИЧ, вирусом гепатита А и моделями вирусов гепатитов В и С, а также безоболочечных вирусов.
Клинические исследования, проведенные в соответствии с критериями Международного Общества по Тромбозу и Гемостазу, а также фармакоэпидемиологические наблюдения по препарату Антитромбин III человеческий не обнаружили передачи с препаратом вирусов гепатитов (HBV, HCV или не-А не-В гепатита) и ВИЧ, хотя в то время ПЦР-тестирование препарата не проводилось.
У больных с геморрагическими диатезами совместное применение антитромбина III и гепарина увеличивает риск кровотечения
Применение антитромбина III в сочетании с терапией гепарином усиливает антикоагулянтный эффект, что должно приниматься во внимание при расчете дозы гепарина. Кроме того, у больных с тромбоцитопенией следует учитывать возможность дефицита тромбоцитарного фактора 4, ведущего к нарушению нейтрализации гепарина и, соответственно, к возрастанию риска кровотечений
Как правило, при комбинированной терапии с гепарином рекомендуется регулярно контролировать АЧТВ и корректировать дозу гепарина. При совместном применении с гепарином доза последнего не должна превышать 500 ME.
У больных с врожденной недостаточностью антитромбина III следует рассматривать возможность проведения соответствующей вакцинации.
Расщепленный и латентный антитромбин
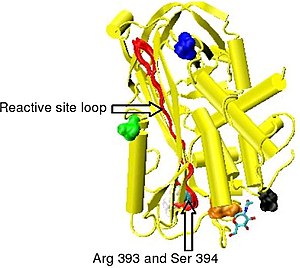 Рисунок 6. Скрытый антитромбин.
Рисунок 6. Скрытый антитромбин.
Расщепление в реактивном сайте приводит к захвату протеазы тромбина с перемещением отщепленной петли реактивного сайта вместе со связанной протеазой, так что петля образует дополнительную шестую цепь в середине бета-листа A. Это движение реактивного сайта Петля также может быть индуцирована без расщепления, с полученной кристаллографической структурой, идентичной таковой физиологически латентной конформации ингибитора-1 активатора плазминогена (PAI-1). По этой причине конформация антитромбина, в которой петля реактивного сайта включена нерасщепленной в основную часть белка, называется латентным антитромбином. В отличие от PAI-1 переход антитромбина от нормальной или нативной конформации к латентной конформации необратим.
Нативный антитромбин можно превратить в латентный антитромбин (L-антитромбин) путем нагревания отдельно или нагревания в присутствии цитрата . Однако без чрезмерного нагревания и при 37 ° C (температуре тела) 10% всего антитромбина, циркулирующего в крови, превращается в L-антитромбин в течение 24 часов. Структура L-антитромбина показана на рисунке 6 .
Трехмерная структура нативного антитромбина была впервые определена в 1994 году. Неожиданно белок кристаллизовался как гетеродимер, состоящий из одной молекулы нативного антитромбина и одной молекулы латентного антитромбина. Скрытый антитромбин при образовании немедленно связывается с молекулой нативного антитромбина с образованием гетеродимера, и только когда концентрация латентного антитромбина превышает 50% от общего антитромбина, он может быть обнаружен аналитически. Не только латентная форма антитромбина неактивна по отношению к его целевым протеазам коагуляции, но и его димеризация с другой активной нативной молекулой антитромбина также приводит к инактивации нативных молекул. Физиологическое влияние потери активности антитромбина либо из-за латентного образования антитромбина, либо из-за последующего образования димеров усугубляется тем, что димеризация происходит между активированным гепарином β-антитромбином и латентным антитромбином в отличие от α-антитромбина.
Форма антитромбина, которая является промежуточным звеном в превращении между нативной и латентной формами антитромбина, также была выделена, и она была названа предварительным антитромбином .
Антитромбин и гепарин
Антитромбин инактивирует свои физиологические целевые ферменты, тромбин, фактор Ха и фактор IXa с константами скорости 7-11 x 10 3 , 2,5 x 10 3 M -1 с -1 и 1 x 10 M -1 с -1 соответственно. Скорость инактивации антитромбин-тромбин увеличивается до 1,5 — 4 x 10 7 M -1 с -1 в присутствии гепарина, т.е. реакция ускоряется в 2000-4000 раз. Ингибирование фактора Ха ускоряется только в 500-1000 раз в присутствии гепарина, а максимальная константа скорости в 10 раз ниже, чем у ингибирования тромбина. Увеличение скорости ингибирования антитромбинового фактора IXa показывает увеличение примерно в 1 миллион раз в присутствии гепарина и физиологических уровней кальция .
AT-III связывается со специфической последовательностью сульфатирования пентасахарида, содержащейся в полимере гепарина.
GlcNAc / NS (6S) -GlcA-GlcNS (3S, 6S) -IdoA (2S) -GlcNS (6S)
После связывания с этой пентасахаридной последовательностью ингибирование активности протеазы усиливается гепарином в результате двух различных механизмов. В одном механизме стимуляция гепарином фактора IXa и ингибирование Ха зависит от конформационных изменений в антитромбине, вовлекающих петлю реактивного сайта, и, таким образом, является аллостерическим . В другом механизме стимуляция ингибирования тромбина зависит от образования тройного комплекса между AT-III, тромбином и гепарином.
Аллостерическая активация
Повышенное ингибирование фактора IXa и Xa требует минимальной последовательности пентасахарида гепарина. Конформационные изменения, которые происходят в антитромбине в ответ на связывание пентасахарида, хорошо задокументированы.
В отсутствие гепарина аминокислоты P14 и P15 (см. Рисунок 3 ) из петли реактивного сайта встроены в основную часть белка (в частности, верхнюю часть бета-листа A). Эта особенность является общей с другими серпинами, такими как кофактор гепарина II , альфа-1-антихимотрипсин и MENT .
Конформационные изменения, наиболее важные для ингибирования факторов IXa и Xa, затрагивают аминокислоты P14 и P15 в N-концевой области петли реактивного сайта (обведены кружком на фиг. 4, модель B ). Эта область получила название шарнирной области. Конформационное изменение в шарнирной области в ответ на связывание гепарина приводит к вытеснению P14 и P15 из основной части белка, и было показано, что предотвращение этого конформационного изменения не приводит к усилению ингибирования факторов IXa и Xa. Считается, что повышенная гибкость, придаваемая петле реактивного сайта в результате конформационного изменения шарнирной области, является ключевым фактором, влияющим на усиление ингибирования факторов IXa и Xa. Было подсчитано, что в отсутствие пентасахарида только одна из каждых 400 молекул антитромбина (0,25%) находится в активной конформации с удаленными аминокислотами P14 и P15.
Неаллостерическая активация
Повышенное ингибирование тромбина требует минимального количества пентасахарида гепарина плюс по крайней мере еще 13 мономерных единиц. Считается, что это связано с требованием, чтобы антитромбин и тромбин связывались с одной и той же цепью гепарина, примыкающей друг к другу. Это можно увидеть в серии моделей, представленных на рисунке 5 .
В структурах, показанных на фиг. 5, С-концевой участок (сторона Р ‘) петли реактивного сайта находится в расширенной конформации по сравнению с другими неактивированными или активированными гепарином структурами антитромбина. Область P ‘антитромбина необычно длинна по сравнению с областью P’ других серпинов, и в неактивированных или активированных гепарином структурах антитромбина образует прочно связанный водородными связями . Удлинение P ‘происходит за счет разрыва всех водородных связей, участвующих в .
Шарнирная область антитромбина в комплексе на фиг. 5 не может быть смоделирована из-за его конформационной гибкости, а аминокислоты P9-P14 не видны в этой структуре. Эта конформационная гибкость указывает на то, что внутри комплекса может существовать равновесие между конформацией антитромбина, вставленной в петлю реактивного сайта P14 P15, и конформацией вытесненной петли реактивного сайта P14 P15. В подтверждение этого, анализ положения P15 Gly в комплексе на Фигуре 5 (обозначенном в модели B) показывает, что он должен быть вставлен в бета-лист A (см. Модель C).
Медицинские офисы KDLmed
- КЛИНИКА 1
- КЛИНИКА 2
- КЛИНИКА 3
АДРЕС:г. Пятигорск, проспект 40 лет Октября, 62/3
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
Взятие крови: пн-сб 7:30 — 12:00
вс 8:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30 / вс 8:30 — 12:00
ТЕЛЕФОН:(8793) 330-640
+7 (928) 225-26-74
АДРЕС:г. Пятигорск, проспект 40 лет Октября, 14
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
Взятие крови: пн-сб 7:30 — 12:00
вс 8:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30 / вс 8:30 — 12:00
ТЕЛЕФОН:(8793) 327-327
+7 (938) 302-23-86
АДРЕС:г. Пятигорск, ул. Адмиральского, 6А
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00
Взятие крови: пн-сб 7:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30
ТЕЛЕФОН:(8793) 98-13-00
+7 (928) 363-81-28
АДРЕС:г. Ставрополь, ул. Ленина, 301
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
ТЕЛЕФОН:(8652) 35-00-01
+7 (938) 316-82-52
- КЛИНИКА 1
- КЛИНИКА 2
АДРЕС:г. Невинномысск, ул. Гагарина, 19
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 15:00
вс 8:30 — 14:00
ТЕЛЕФОН:(86554) 7-08-18
+7 (928) 303-82-18
АДРЕС:г.Невинномысск, ул. Гагарина, 60
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 13:00
ТЕЛЕФОН:8 (86554) 6-08-81
8 (938) 347-42-17
АДРЕС:г. Нефтекумск, 1-й микрорайон, ул. Дзержинского, 7
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86558) 4-43-83
+7 (928) 825-13-43
АДРЕС:г. Буденновск, пр. Энтузиастов, 11-Б
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86559) 5-55-95
+7 (938) 302-23-89
АДРЕС:г. Зеленокумск, ул. Гоголя, д.83
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86552) 6-62-14
+7 (938) 302-23-90
АДРЕС:г. Минеральные Воды, ул. Горская, 61, 13/14
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 16:00 / вс 8:30 — 15:00
ТЕЛЕФОН:(87922) 6-59-29
+7 (938) 302-23-88
- КЛИНИКА 1
- КЛИНИКА 2
АДРЕС:г. Ессентуки, ул. Володарского, 32
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:30 / вс 8:30 — 13:00
ТЕЛЕФОН:(87934) 6-62-22
+7 (938) 316-82-51
АДРЕС:г.Ессентуки, ул.Октябрьская 459 а
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 14:30
ТЕЛЕФОН:(87934) 99-2-10
+7 (938) 300-75-28
АДРЕС:г. Георгиевск, ул. Ленина, 123/1
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
ТЕЛЕФОН:(87951) 50-9-50
+7 (938) 302-23-87
АДРЕС:г. Благодарный, ул. Первомайская, 38
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86549) 24-0-24
+7 (928) 363-81-37
АДРЕС:г. Светлоград, ул. Пушкина, 19 (Центр, Собор)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86547) 40-1-40
+7 (928) 363-81-41
АДРЕС:с. Донское, ул. 19 Съезда ВЛКСМ, 4 А
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86546) 34-330
+7 (928) 363-81-25
АДРЕС:г. Новоалександровск, ул. Гагарина, 271 (пересечение с ул. Пушкина)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8(86544) 5-46-44
+7 (928) 363-81-45
АДРЕС:с. Александровское, ул. Гагарина, 24
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86557) 2-13-00
+7 (928) 363-81-35
АДРЕС:с. Кочубеевское, ул. Братская, 98 (ТЦ «ЦУМ»)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 13:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86550) 500-22
+7 (928) 363-81-42
АДРЕС:г. Железноводск, ул. Ленина, 127
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 17.30
сб 7:30 — 13:00
ТЕЛЕФОН:(87932) 32-8-26
+7 (928) 363-81-30
АДРЕС:с. Арзгир, ул. Кирова, 21 (Рынок)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 14:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86560) 31-0-41
+7 (928) 363-81-44
АДРЕС:г.Ипатово, ул. Ленинградская, 54
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8 (86542) 5-85-15
8 (938) 347-42-16
АДРЕС:ст. Ессентукская, ул. Павлова, 17
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:30
ТЕЛЕФОН:8 (87961) 6-61-00
8 (938) 347-42-18
АДРЕС:ст. Курская, ул. Калинина, д. 188
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8(87964) 5-40-10
8(938) 347-43-29
- Пятигорск
- Ставрополь
- Невинномысск
- Нефтекумск
- Буденновск
- Зеленокумск
- Минеральные Воды
- Ессентуки
- Георгиевск
- Благодарный
- Светлоград
- Донское
- Новоалександровск
- Александровское
- Кочубеевское
- Железноводск
- Арзгир
- Ипатово
- Ессентукская
- Курская
Описание
Антитромбин III — специфический белок, который является одним из основных противосвертывающих веществ человеческой крови, синтезирующийся, в основном, в сосудистом эндотелии и клетках печени. Он препятствует избыточному образованию тромбов (до 75% угнетающей тромбин способности плазмы) и играет важную роль в поддержании нормального гемостаза.
При самостоятельном воздействии инактивация тромбина протекает медленно, по нарастающей. При наличии гепарина процесс инактивации развёртывается очень быстро. Поэтому АТ III называют плазменным кофактором гепарина. Но в случае значительного снижения уровня АТ III гепарин почти не оказывает своего антикоагулянтного действия. АТ III также принимает активное участие в инактивации факторов VIIA, IXA, XA, XIA, XIIA. Механизм инактивации посредством АТ III состоит в образовании комплекса, в котором происходит необратимое соединение молекулы тромбина и молекулы антитромбина III. Снижение уровня антитромбина III свидетельствует о риске возникновения тромбоза. Показания:
- наследственный дефицит антитромбина III;
- применение антикоагулянтов для профилактики тромбоэмболических осложнений при длительной неподвижности, хирургических вмешательствах, травме, беременности, родах.
Подготовка
Специальная подготовка не требуется. Взятие крови рекомендуется проводить не ранее, чем через 6–8 часов после последнего приема пищи. Накануне исследования следует исключить приём алкоголя и курение, физические и эмоциональные нагрузки.
Если пациент принимает лекарственные препараты, следует проконсультироваться с врачом по поводу целесообразности проведения исследования на фоне приёма препаратов или возможности его отмены перед исследованием, длительность отмены определяется периодом выведения препарата из крови.Интерпретация результатов
Единицы измерения: %.
Референсные значения: 83–128%. Повышение уровня:
- воспалительные процессы;
- острый гепатит;
- холестаз;
- дефицит витамина К;
- приём антикоагулянтов;
- тяжёлый острый панкреатит;
- рак поджелудочной железы;
- менструация;
- лечение анаболическими препаратами.
Увеличение уровня антитромбина III сопряжено с повышенным риском кровотечений и наиболее часто связано с длительным приемом непрямых антикоагулянтов (варфарин, фенилин и др.), дефицитом витамина К, острым вирусным гепатитом, выраженным воспалительным процессом. Возможно кратковременное увеличение количества антитромбина III во время менструации.
Понижение уровня:
- врождённый дефицит;
- атеросклероз;
- последний триместр беременности;
- после хирургических операций, при заболеваниях печени (хронические гепатиты, цирроз);
- острый ДВС-синдром;
- хроническая печёночная недостаточность;
- тромбоэмболия;
- сепсис;
- введение гепарина;
- приём пероральных контрацептивов.
Симптомы проявления побочных эффектов
Негативными проявлениями при проведении терапии Антитромбин, могут быть следующие нижеописанные побочные эффекты.
- Система пищеварения. Возникновение состояния тошноты и рвотных позывов.
- Сердце и сосудистая система. Может развиваться учащенное сердцебиение, снижаться артериальное давление.
- Кожные покровы. При проведении терапии возможно покраснение кожи, ощущение жжения в месте введения инъекции.
- Иммунная система. Возможно возникновение реакций, аллергического характера: тяжелых форм анафилактических проявлений, отека Квинке, генерализированных покраснений и сыпных реакций.
- Нервная система. Возникновение болезненных ощущений в области головы, покалывания и состояния беспокойства.
- Дыхательный аппарат. Возможно возникновение свистящего дыхания.
- Лабораторные исследования. Возможно снижение тромбоцитного уровня на пятьдесят процентов.
- Общее. Может возникать состояние сонливости, озноба, лихорадочных ощущений.
- Также в очень редких случаях возможны проявления гепарин-индуцированной тромбоцитопении.
Данная инструкция по применению не может описать все негативные эффекты. Которые могут возникать во время проведения терапевтического курса Антитромбином. Поэтому при возникновении любых дискомфортных ощущений следует сообщить о них своему лечащему врачу.
Влияние гликозилирования на активность
α-Антитромбин и β-антитромбин различаются по своему сродству к гепарину. Разница в константе диссоциации между ними составляет трехкратную для пентасахарида, показанного на фиг. 3, и более чем десятикратную для полноразмерного гепарина, причем β-антитромбин имеет более высокое сродство. Считается, что более высокое сродство β-антитромбина связано с повышенной скоростью, с которой происходят последующие конформационные изменения в белке при начальном связывании гепарина. Считается, что для α-антитромбина дополнительное гликозилирование по Asn-135 не мешает начальному связыванию гепарина, а скорее ингибирует любые возникающие конформационные изменения.
Несмотря на то, что он присутствует только на 5–10% уровней α-антитромбина из-за его повышенного сродства к гепарину, считается, что β-антитромбин более важен, чем α-антитромбин, в контроле тромбогенных явлений, возникающих в результате повреждения тканей. Действительно, ингибирование тромбина после повреждения аорты приписывается исключительно β-антитромбину.
Фармакологические свойства
Лекарственный препарат Антитромбин iii человеческий представляет собой гликопротеиновое вещество, принадлежащее к серпиновому суперсемейству, и является антикоагулянтом прямого действия. Серпины — ингибиторы протеаз серина.
Активное вещество обладает блокирующим свойством процесса свертывания крови. В частности оно воздействует на тромбиновый фактор, на компонент активатора протромбина – фактор Ха, а также ингибирует контактную активацию внутренних механизмов свертывающей кровь системы и тканевого тромбопластина.
Активизация свойств гликопротеина значительно увеличивается при комплексном использовании с гепариновыми веществами.
В состав Антитромбина входит два домена, обладающих различными функциями. Первый – гепарин-связывающий, отвечает за реакции взаимодействия с гепариновыми веществами и увеличивает скорость ингибирования тромбина. Второй домен – гепарин-ингибирующий, являющийся необходимым для образования связки протеиназа-ингибитор и включающий в себя наличие активного центра и участка, расщепляющего протеиназы.
Антитромбин активно участвует в инактивационных процессах VIIA, IXA, XA, XIA, XIIA факторов, которые происходят в механизме необратимого соединения молекул описываемого вещества и тромбина.
Снижение антитромбиновых показателей в крови указывают на возможность возникновения тромбозов.
Номенклатура
Антитромбин также называют Антитромбином III (AT III). Обозначения от антитромбина I до антитромбина IV возникли в ранних исследованиях, проведенных в 1950-х годах Сигерсом, Джонсоном и Феллом.
Антитромбина I (АТ I) , относится к поглощению тромбина на фибрин после тромбина активировал фибриногена . Антитромбин II (AT II) относится к кофактору в плазме, который вместе с гепарином препятствует взаимодействию тромбина и фибриногена . Антитромбин III (AT III) относится к веществу в плазме, которое инактивирует тромбин. Антитромбин IV (AT IV) относится к антитромбину, который активируется во время и вскоре после свертывания крови . Только AT III и, возможно, AT I имеют медицинское значение. AT III обычно называют исключительно «Антитромбином», и именно Антитромбин III обсуждается в этой статье.